.
Condición fitosanitaria: Plaga Cuarentenaria Presente
Grupo de cultivos: Frutícolas (Carozo)
Especie hospedante: Ciruelo (Prunus domestica L.), duraznero (Prunus persica (L.) Batsch.), damasco (Prunus armeniaca L.), nectarinas (Prunus persica var. nucipersica (Borkh.) C.K. Schneid., híbridos) y almendro (Prunus dulcis (Mill.) D. A. Webb, syn. P. amygdalus (L.) Batsch.), cerezo dulce (Prunus avium L.) y cerezo ácido o guindo (Prunus cerasus L.) (Damsteegt et al., 2007). Los cerezos y guindos se comportan como resistentes.
Rango de hospedantes: específico / estrecho, infecta Prunoideae (Prunus spp). El PPV es capaz de infectar una gran variedad de especies de plantas, incluyendo árboles del género Prunus (Collum et al., 2021), su hospedante natural. Sin embargo, se cree que existen otros posibles hospedantes que actúan como reservorios del virus, ya que el PPV se ha transmitido experimentalmente a muchas plantas herbáceas (p. ej., tomate, arveja, petunia) así como a muchas malezas (p. ej., trébol blanco, Chenopodium album, Ranunculus bulbosus). Cuando algunos aislados de PPV se propagan durante un tiempo prolongado en plantas herbáceas, su capacidad para infectar árboles se reduce (Salvador et al., 2008).
Epidemiología: es considerada una enfermedad poliética.
Transmisión: áfidos, NO persistente.
Etiología: Virus (parásito obligado o biotrófico como todos los virus)
Agente causal: Plum pox virus
Taxonomía: Viruses > Riboviria> Orthornavirae > Pisuviricota > Stelpaviricetes > Patatavirales > Potyviridae > Potyvirus
ICTV: virus ssRNA> virus ssRNA de cadena positiva> sin etapa de ADN> Potyviridae> Potyvirus
Baltimore classification: Group IV: ssRNA(+) Baltimore, 1971
.
Los miembros de la familia Potyviridae pertenecen a un grupo de virus de plantas que causan enfermedades devastadoras de las plantas con un impacto significativo en la agronomía y la economía (Sochor et al., 2012).
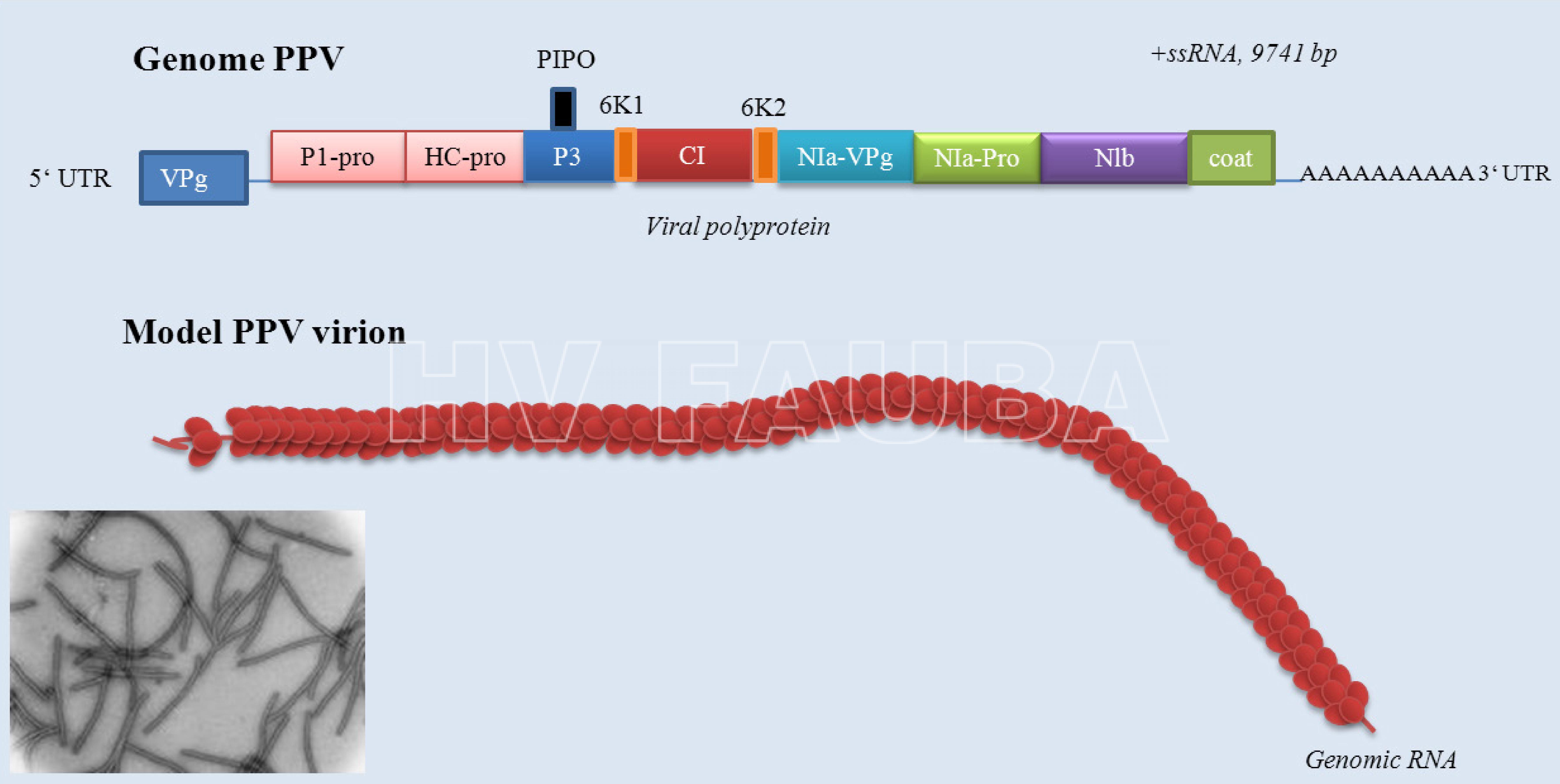
El Plum pox virus (PPV) es un miembro de los Potyvirus que se caracteriza por presentar una partícula de simetría helicoidal, flexuosa, de 750 nm de longitud que contiene una cadena simple de RNA (ss-RNA). Su infección está asociada, a la presencia, en el citoplasma, de cuerpos de inclusión de estructura laminar con aspecto de aspas de molino.
El genoma de PPV consta de un ARN monocatenario de 9 786 nucleótidos. Este ARN genómico se traduce en una poliproteína grande que es escindida proteolíticamente por tres proteinasas autocodificadas para producir al menos 10 productos proteicos maduros. El ARN está recubierto de una proteína, la CP de aprox. 2000 subunidades peptídicas, formando partículas flexuosas y filamentosas (750 x 20 nm).
.
.
- Genoma de Plum Pox Virus (Potyvirus). CP: proteina de la capside; P1: P1 proteinasa; HC-pro: componente de ayuda de la proteinasa; P3: proteina P3; PIPO: proteina; CI: proteina de inclusion cytoplasmatica; Nia-VPg: proteína viral ligada al genoma; NIa-Pro: proteína de inclusión nuclear a; Nib: proteína de inclusión nuclear N (ARN polimerasa dirigida por ARN). Fuente: Sochor et al., 2012
.
.
.
Razas de PPV
Existen diferentes cepas o razas de este virus. Se han descrito diferentes cepas o razas del virus en base a síntomas observados al infectar diferentes plantas hospedantes en forma experimental. De acuerdo con la clasificación basada en Chenopodium foetidum Lam. como planta indicadora, los aislamientos de PPV se clasifican en cepas amarillas, intermedias y necróticas (Sutic et al., 1971). La clasificación basada en datos de biología molecular reconoció inicialmente seis cepas de Plum pox virus. Sin embargo, continuamente se producen y reconocen nuevas cepas.
La población de PPV comprende siete cepas distintas, en su mayoría no recombinantes, y otros dos grupos de cepas, que son la progenie de diferentes eventos recombinantes (ver tabla a continuación). También hay recombinantes individuales que tienen padres europeos. Solo la cepa n-rec PPV-D se ha extendido ampliamente a partir de su población parental europea, y se ha expandido con incursiones establecidas en Canadá, Japón, la República de Corea y los EE.UU.
En Argentina se ha detectado la raza PPV-D, la cual afecta a los ciruelos, durazneros, damascos y algunas especies ornamentales. Las secuencias genómicas analizadas fueron 98% idénticas con la cepas PPV-D de Estados Unidos (GenBank AF360579) y Alemania (GenBank X81081) (Zotto et al., 2006).
.
Cepas o razas (strains/isolates) de PPV, de acuerdo con Sochor et al., 2012.
.
.
.
Antecedentes
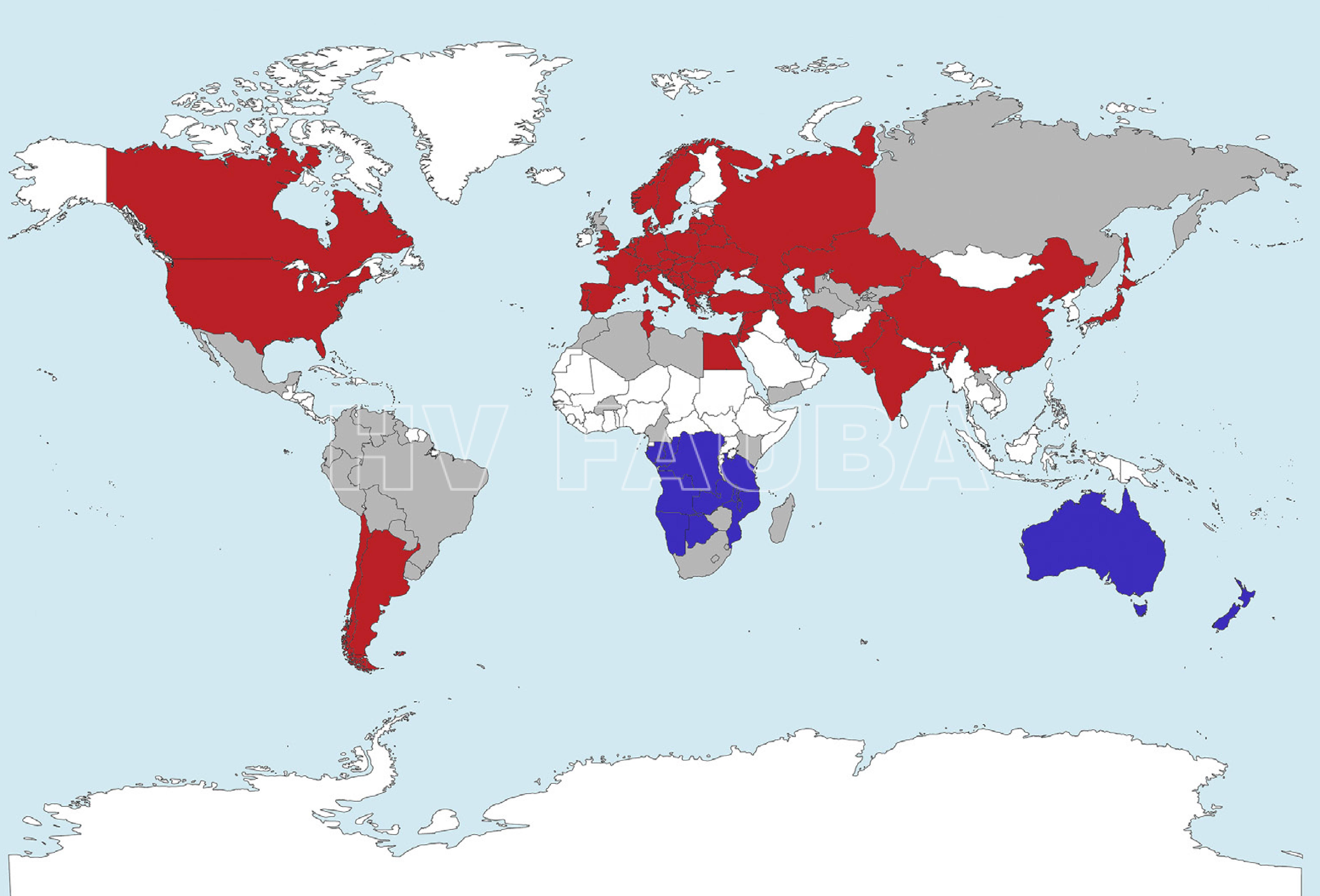
La viruela de los ciruelos o Sharka (“sharka” = viruela en búlgaro) constituye la enfermedad más grave que afecta a los frutales de carozo en todo el mundo, por los daños que produce. Es causada por un potyvirus originario de Europa, donde se encuentra extendida y ha ocasionado pérdidas millonarias en los países europeos en tanto que, en la actualidad, amenaza nuestra producción. Afecta a todas las especies del género Prunus inclusive las ornamentales. Esta virosis fue detectada por primera vez en Bulgaria hacia 1915, y descrita como una enfermedad viral en 1932 (Atanasoff, 1932, 1935). Posteriormente, la enfermedad se propagó progresivamente a través de material vegetal de propagación infectado por Europa, durante los 1970’s. Actualmente se encuentra en toda Europa, excepto en Finlandia, afectando almendros, ciruelos, damascos y durazneros; y se la ha considerado la enfermedad más devastadora de las frutas de carozo en toda Europa durante muchos años. También se encuentra en Egipto, Turquía, Siria, India y África. El PPV se reportó por primera vez en los Estados Unidos en una pequeña zona de Pensilvania en octubre de 1999 (Douglas SM). Se encuentra presente en Chile desde el año 1993. La Argentina estaba libre del virus hasta que, a fines del 2004, fue detectado un brote de la enfermedad en plantas de ciruelo y damasco en el Dpto. de Pocito, en la provincia de San Juan (Zotto et al., 2006). Ni bien fue localizado el foco enfermo, la Dirección de Cuarentena Vegetal del SENASA intervino oportunamente confirmando el diagnóstico y tomando intervención. Es por ello que se erradicaron las plantas del monte afectado y se realizaron monitoreos en fincas vecinas con el objeto de detectar otros posibles focos de la enfermedad. Además, la Resolución Nº 24/2005 del SENASA declaró la emergencia fitosanitaria respecto al sharka, estableciendo lo siguiente: “Está prohibido el movimiento de todo material vegetal del género Prunus, las plantas y sus partes, excepto sus frutos, en todo el territorio nacional, sin previa autorización del SENASA. El propietario, poseedor o tenedor del predio donde se detecten síntomas debe comunicar obligatoriamente al SENASA, a través del SINAVIMO (Servicio Nacional de Vigilancia y Monitoreo) la existencia o sospecha de la enfermedad. Si se observa cualquiera de los síntomas descriptos, aunque sea en una rama sola, se debe dar aviso inmediato al SENASA a través del SINAVIMO, dirigiéndose a la oficina local más cercana o enviando un mail a viveros@senasa.gob.ar” Por tanto, queda establecido que, en caso de detectarse un lote con plantas enfermas con sospecha de sharka, debe darse de inmediato aviso al SENASA el cual procederá (previa verificación) a su erradicación.
.
Importancia económica y daños
La enfermedad de Sharka es la enfermedad más destructiva de los frutales de carozo (Prunus sp.) a nivel mundial, debido principalmente a los serios daños que provoca en los frutos, impidiendo su comercialización. El virus del sharka produce síntomas característicos en hojas, flores y/o frutos de ciruelos, damascos y durazneros. Es la enfermedad más severa de los ciruelos en Europa aunque no mata a los árboles. Sin embargo, es el virus de Prunoideas más destructivo no sólo por las pérdidas que ocasiona sino por lo amplio de su distribución geográfica. El 40% de las ciruelas pueden caer antes de la maduración; en los cultivares susceptibles, del 80 al 100%. En durazneros, las manchas en la piel de los frutos disminuyen su valor comercial. Las pérdidas por caída de frutos son sumamente importantes. Las frutas que quedan son indeseables para el consumo directo, el secado o la industria. El INTA elaboró el Proyecto Nacional Nº 52-0509 para “Detección precoz de Sharka y Tizón de Fuego”. Cabe destacar que el tizón del fuego, enfermedad muy grave, de origen bacteriano (Erwinia amylovora (Burrill) Winslow), no ha sido detectada en nuestro país.
.
- Distribución mundial de PPV. Zonas rojas, PPV presente; áreas violeta, no hay datos sobre la ocurrencia de PPV; áreas gris claro, PPV ausente; áreas blancas, sin cultivos de Prunus. Autor: De Mori et al., 2020.
.
.
Síntomas
Los síntomas causados por el PPV varían de acuerdo con varios factores, incluyendo las especies y cultivares del hospedante, la edad al momento de la infección, el estado nutricional y las condiciones ambientales. Los síntomas generales de infección incluyen la presencia de manchas o «viruela» en frutos, hojas, tallos y semillas. Algunas plantas infectadas no muestran ningún síntoma claro o es posible que no desarrollen síntomas hasta varios años después de la infección.
La actividad del virus causa la enfermedad provocando anillos cloróticos en la fruta y las hojas de las plantas infectadas. El fruto de las plantas infectadas puede ser de peor calidad y estar deformado. Los síntomas varían según el tipo de planta, la variedad, el estado de la planta, la época del año y el momento en que la planta fue infectada. Es posible que muchos árboles no muestren síntomas durante los primeros años después de la primera infección. Los síntomas en el duraznero maduro consisten en anillos cloróticos o patrones de líneas. Las frutas de damasco y ciruela suelen tener protuberancias. Las variedades de ciruelas europeas pueden desarrollar áreas rojas decoloradas y caer prematuramente, mientras que las ciruelas japonesas muestran síntomas de manchas anulares. La cepa D puede causar manchas necróticas graves en las hojas de algunas variedades de ciruela; los durazneros pueden tener manchas y rayas cloróticas, y las hojas de damasco generalmente solo muestran síntomas leves. Los síntomas de las hojas se ven más fácilmente en primavera.
Los síntomas del PPV a veces son difíciles de distinguir de otras enfermedades y pueden confundirse con la enfermedad «rusty spot» (causada por el hongo Podosphaera leucotricha) en durazneros y nectarinas, así como problemas relacionados con insectos como daños por trips, chicharritas, etc.
.
* Síntomas en almendros y ciruelos. Al comienzo de la primavera, en las hojas jóvenes, se observan anillos, puntos, bandas, líneas ó diseños en hoja de encina de color verde pálido o amarillento de diferentes tamaños en función del genotipo del hospedante. Las temperaturas de verano pueden enmascararlos. Previo a la madurez de los frutos, aparecen anillos o manchas de color azul oscuro. A medida que la maduración avanza, las manchas se necrosan y se deprimen ocasionando deformaciones en el fruto con grietas profundas. Los tejidos cercanos se oscurecen y exudan gomas. Los frutos son de menor tamaño, deformes y con escaso contenido de azúcar, pudiendo caer 20 ó 30 días antes de la cosecha. En ramas de 2 ó más años pueden visualizarse cancros aplanados y agrietados. Las temperaturas de verano también pueden enmascarar dichos síntomas. Antes de la madurez de los frutos aparecen anillos o manchas azuladas oscuras.
.
- 01 Síntomas de PPV en ciruela. Fuente: EPPO Global Database.
- 02 Síntomas de PPV en ciruela. Fuente: EPPO Global Database
- 03 Síntomas de PPV en ciruela. Fuente: EPPO Global Database
- 04 Los frutos externamente pueden mostrar deformaciones, que al tacto suelen ser protuberancias o surcos irregulares. Hay caída de frutos en ciruelo europeo. Autor: Ing. Juan Manuel Raigon
- 01 Síntomas foliares del PPV, ciruelo cultivar Fränkischer. Fuente: EPPO Global Database
- 02 Síntomas foliares del PPV, ciruelo cultivar Great Green. Fuente: EPPO Global Database
- 03 Síntomas foliares del PPV, ciruelo cultivar Ruth Gerstetter. Fuente: EPPO Global Database
- 04 Síntomas foliares del PPV, ciruelo cultivar St Julien. Fuente: EPPO Global Database
- 05 Síntomas foliares del PPV, ciruelo cultivar Brompton. Fuente: EPPO Global Database
- 06 Síntomas foliares del PPV, ciruelo cultivar Ackermann. Fuente: EPPO Global Database
.
* Síntomas en durazneros. En árboles jóvenes se pueden observar, con dificultad, en las hojas, líneas cloróticas a lo largo de las nervaduras secundarias y terciarias. La nervadura central puede necrosarse y fruncirse la lámina foliar. En frutos, el síntoma característico es la aparición de manchas o anillos amarillos o blancos sobre las variedades de pulpa amarilla o blanca, respectivamente. En cultivares susceptibles se producen serias deformaciones del fruto y caída prematura de los mismos. En las flores, los síntomas pueden observarse como un cambio de color en los pétalos (quebrado), especialmente, cuando se trata de las razas virales más agresivas.
.
- (A) Flores de durazno que muestran manchas típicas de árboles infectados con PPV. Notar las rayas rosa oscuro en los pétalos. (B) Se desarrollan anillos y manchas cloróticas en las hojas de duraznero. (C) Anillos amarillos en un cultivar de duraznero de pulpa amarilla. (D) Patrones de anillos visibles en el carozo de un damazco. Autor: Sochor et al., 2012.
- Síntomas de PPV en durazno. Fuente: EPPO Global Database.
.
.
* Síntomas en damascos. Al inicio de la primavera, se pueden observar en las hojas líneas, anillos o manchas verde pálido que permanecen hasta mediados del verano. Poco antes de la cosecha aparecen en la fruta síntomas de sequedad y dureza de la pulpa. En el carozo es posible observar anillos pardo amarillentos. Estas lesiones presentan un borde interno definido en tanto que el externo se evidencia difuso.
.
.
.
Además de los síntomas descritos anteriormente, las infecciones por PPV pueden imitar los síntomas asociados con otros problemas, como las deficiencias nutricionales. El PPV también reduce la cantidad total de fruta y la calidad de la fruta sintomática y asintomática. Las infecciones por PPV pueden reducir la vida productiva de los árboles y también pueden provocar muchos cambios fisiológicos y metabólicos anormales. Este virus no causa la muerte de los árboles infectados y muchas veces estos pueden no mostrar síntomas (infecciones asintomáticas) por largos períodos, que pueden variar desde 1 a 4 años (enfermedad poliética). Las plantas enfermas si no son erradicadas, actúan como fuente de contagio de la enfermedad a los otros árboles sanos de la plantación. Aunque el PPV por lo general no mata los árboles, puede causar graves pérdidas económicas al hacer que la fruta no sea comercializable debido al mal sabor y las deformaciones, y al causar una caída prematura de la fruta extensa.
.
Transmisión
Su forma más importante de transmisión es por injerto y por propagación de materiales vegetales infectados.
La trasmisión por semilla varía entre el 23-79%.
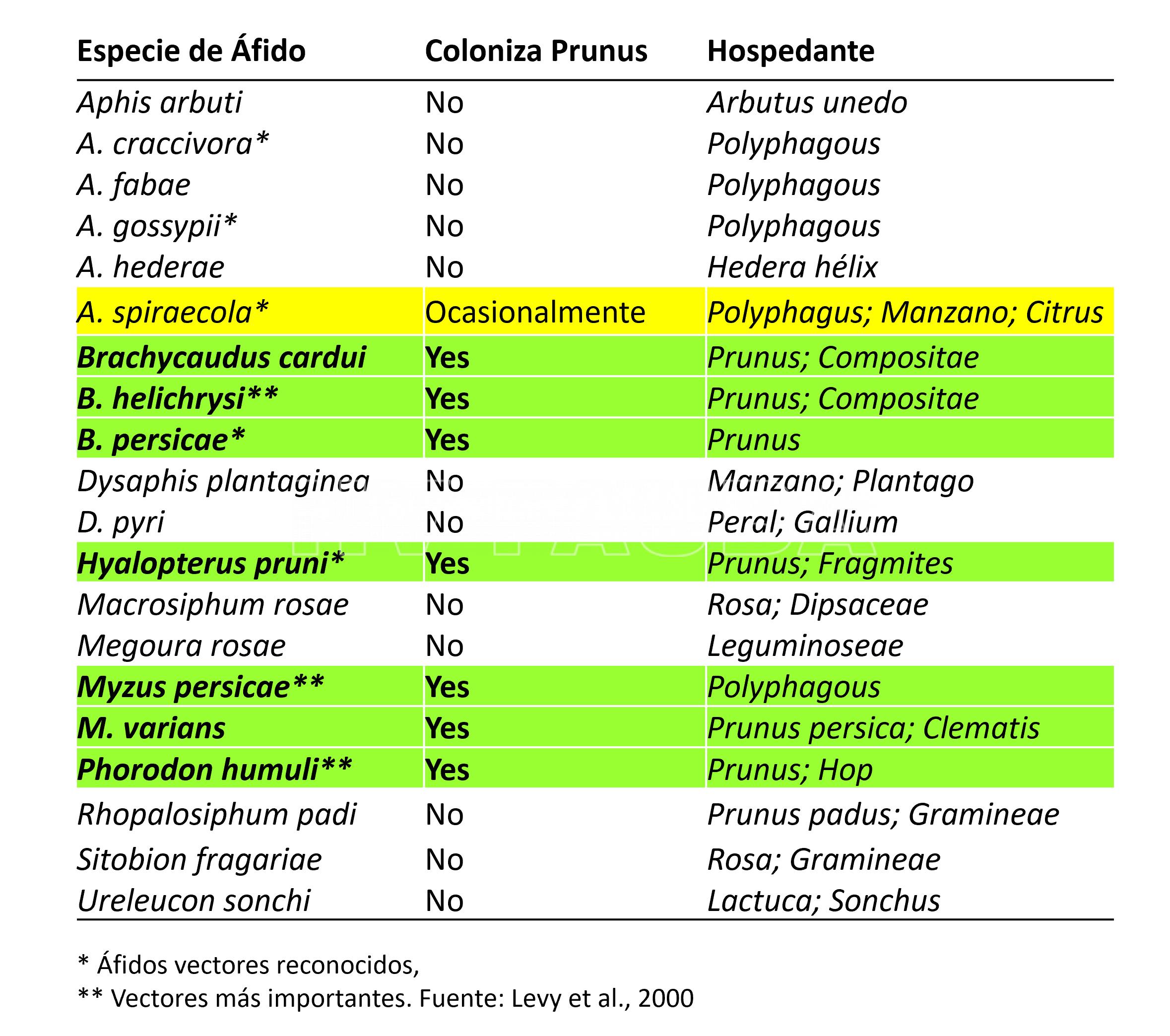
El virus se trasmite activamente por áfidos en forma no persistente. Entre las especies que lo transmiten más eficientemente se encuentran: Myzus persicae, Brachycaudus cardui, B. helichrysi, Phorodon humuli, entre otras (ver tabla a continuación).
En entornos naturales como los montes frutales, los pulgones propagan el PPV a distancias cortas. La propagación a larga distancia del PPV se produce principalmente a través de material vegetal infectado. El PPV se propaga fácilmente en las yemas y el material de vivero. Este medio de propagación probablemente representa la mayor parte de la propagación a diferentes regiones geográficas, ya que el material vegetal infectado a menudo no presenta síntomas. Es poco probable que los pulgones se propaguen a larga distancia.
.
.
.
.
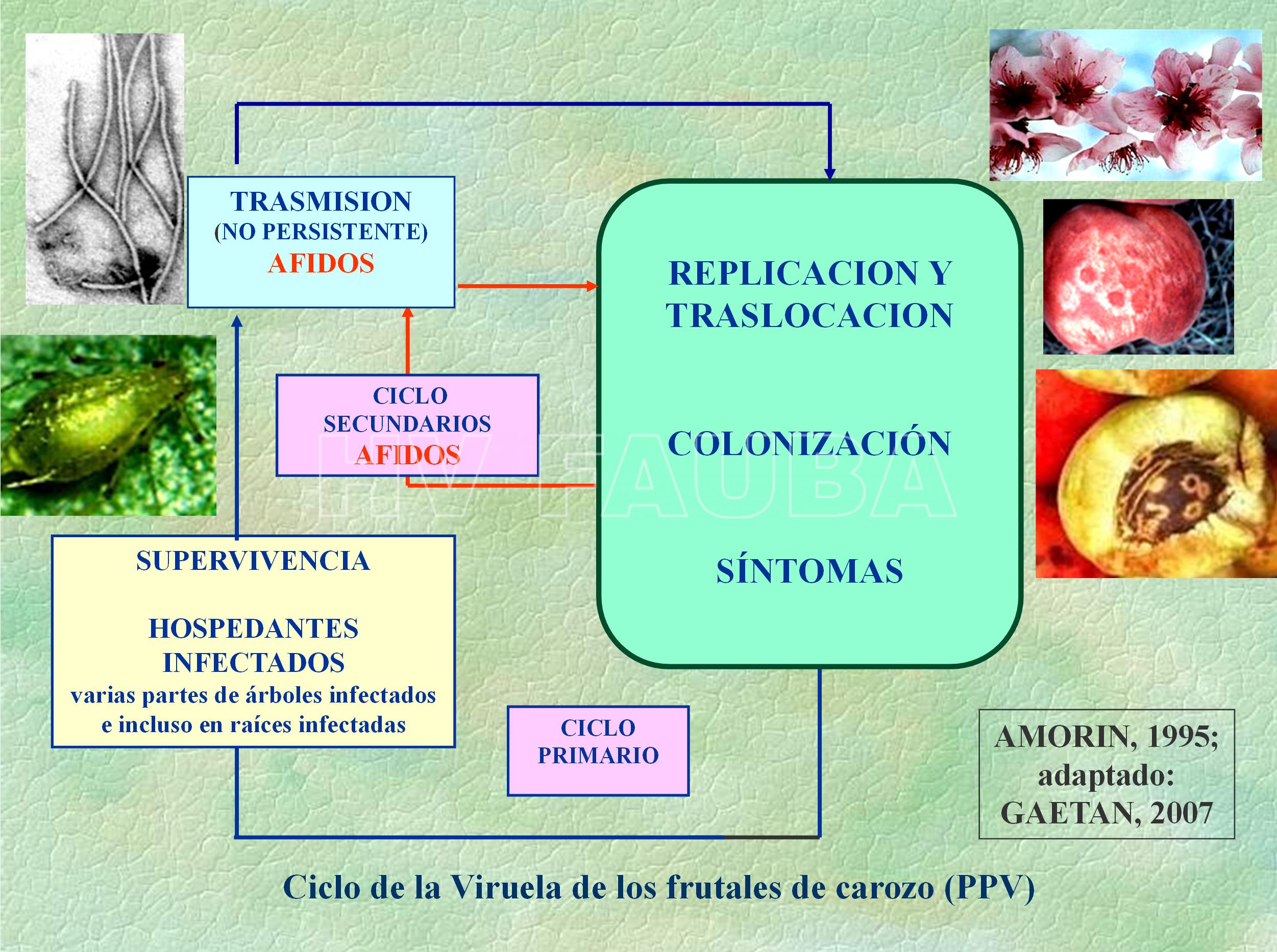
Ciclo de la enfermedad y epidemiología
Una vez establecido el virus es extremadamente difícil su erradicación. La fuente principal de inóculo de PPV son los Prunus (durazneros, nectarinas, ciruelos y damascos) infectados. El virus se propaga a nuevas áreas al mover material vegetal de propagación no certificado a través de brotes, injertos y trasplantes, y con la migración de pulgones. El virus se transmite por medio de áfidos o pulgones que lo transmiten en forma no persistente. Los áfidos son efectivos para propagar el VPP dentro de un árbol y a los árboles adyacentes. Los pulgones tienen varias generaciones por año y tienen formas aladas para moverse de un árbol a otro. La propagación de los pulgones a largas distancias es poco común. La dispersión a través de áfidos ocurre, en general, siguiendo un gradiente. Esta dispersión secundaria puede ser rápida debido a la acción de más de 20 especies de pulgones que actúan como vectores, entre los cuales, se encuentra Myzus persicae.
Una característica especial de este virus es su distribución desuniforme en las plantas afectadas haciendo que su diagnóstico se vea dificultado. Marini et al. (2015) y Zotto et al. (2020), mediante la detección de PPV con la técnica serológica DAS-ELISA, encontraron una alta variación de los niveles de concentración relativa de virus entre meses, dentro y entre años en Argentina. Con respecto a las diferentes partes de la planta, la concentración relativa de virus disminuyó desde la base hasta la parte apical, lo que indica que el muestreo debe realizarse a una altura basal.
El período de incubación puede variar entre 9 a 13 meses mientras que la propagación sistémica del virus a toda la planta en los árboles pequeños transcurre en un lapso de 2 a 3 años. En montes adultos, la enfermedad aparece, inicialmente, en forma aleatoria y, posteriormente, se van infectando los árboles próximos a otros infectados previamente. Este es un típico patrón de dispersión a través de vectores aéreos. El 48% de las plantas contenidas en un círculo de 100 m alrededor de un individuo infectado, se contagian en un lapso de 10 años. Las plantaciones libres de sharka deben mantenerse a una distancia mínima de 500 m de una planta infectada, para mantenerlas sanas.
* El período de incubación es de 9 a 13 meses o años (hasta 3-4 años).
* La propagación del virus en la planta es sistémica, de 2 a 3 años.
* Los síntomas aparecen generalmente después de 3 años de establecida la infección.
* La planta puede estar enferma y no manifestar síntomas visibles.
* Las partículas virales se distribuyen en forma muy heterogénea dentro de la planta.
* En los montes frutales la enfermedad se manifiesta en forma aleatoria, y luego se va distribuyendo hacia árboles aledaños.
* Desde el punto de vista epidemiológico, el Sharka es considerada una enfermedad poliética.
.
- Ciclo agronómico de la Viruela de los frutales de carozo (Plum Pox Virus-PPV). Fuente: Amorin L, 1995; adaptado por Gaetan SA, 2007.
.
.
Diagnóstico y manejo de la enfermedad
El control de Sharka depende de la posibilidad de contar con plantas sanas obtenidas mediante programas de certificación. Los materiales son sometidos a controles sanitarios exhaustivos ya que constituyen fuentes potenciales de la enfermedad y, al mismo tiempo, son monitoreados previo a su comercialización a viveristas y productores. Los laboratorios del SENASA reciben todos los años muestras provenientes de las provincias de Mendoza, San Juan, Alto Valle de Río Negro y de Buenos Aires para ser analizadas por esta enfermedad. Durante el muestreo, se obtienen hojas de varias ramas para asegurar su ausencia, dada la distribución irregular del virus. Se utiliza una técnica serológica (ELISA), en la cual se usan anticuerpos específicos que detectan las proteínas del virus. En caso de aparecer muestras positivas o dudosas por esta técnica, el resultado se confirma por otra técnica que se llama RT-PCR en tiempo real (qPCR).
También se puede diagnosticar mediante el uso de plantas indicadoras (ej. Chenopodium foetidum).
En montes frutales en producción, en general no resulta de mucha utilidad controlar al pulgón dado que este vector transmite el virus en forma no persistente. Otra medida que complementa a las estrategias mencionadas es la erradicación de árboles infectados aunque los síntomas de la enfermedad sólo se manifiesten en porciones muy restringidas del árbol, una rama por ejemplo. En Europa, se evaluó la eficiencia de los tratamientos con aceite mineral en parcelas experimentales de vivero. El tratamiento con emulsión al 1% no evitó la infección natural por PPV en áreas con alta prevalencia de PPV pero redujo significativamente el porcentaje de plantas de vivero infectadas con PPV, limitando significativamente la propagación de la enfermedad. Por lo tanto, el uso de aceite mineral es muy recomendable en viveros y plantaciones jóvenes, en particular durante el pico de vuelo de las especies de pulgón y/o tan pronto como se detecten los primeros pulgones virulíferos con PPV sean detectados.
Por otra parte, la propagación vegetativa de los portainjertos de almendro, ciruelo y duraznero ha sido una importante vía de propagación de la enfermedad. Muchas veces, la infección pasa inadvertida en plantas de vivero que no producen frutos, ya que los portainjertos tolerantes la enmascaran pero no disminuyen la infección del cultivar infectado.
Detección precoz de Sharka. INTA. LINK
.
MANEJO INTEGRADO
* Prevención (exclusión): el control más eficaz es prevenir la introducción del patógeno en una región geográfica determinada. Esto implica la compra de material de propagación certificado libre de virus, así como la atención al movimiento internacional de material vegetal (fiscalización oficial).
* Erradicación de árboles infectados y hospedantes reservorios: es fundamental la eliminación y destrucción inmediata y completa de árboles sintomáticos y asintomáticos con detección positiva por PCR. Dado que los árboles no se pueden curar del virus una vez infectados, la eliminación es la única forma eficaz de limitar la propagación de la enfermedad. El PPV puede «sobrevivir» durante el invierno en varias partes de los árboles infectados e incluso en las raíces infectadas. Los chupones de rápido crecimiento de portainjertos infectados son fuentes de inóculo bien documentadas del virus. Una vez que se eliminan los árboles, es importante asegurarse de que los pulgones no tengan la oportunidad de alimentarse de las hojas, ya que aún pueden adquirir y propagar el virus antes de que el árbol sea destruido. Dado que el papel de los hospedantes alternativos que actúan como reservorios aún no se comprende bien, las malezas o plantas con síntomas «inusuales» que se encuentran cercanos a los árboles sospechosos de infección pueden eliminarse y destruirse como medida de precaución.
* Manejo y control de vectores (?): En la actualidad, no existen formas efectivas de proteger completamente los árboles frutales de las actividades de alimentación de pulgones. Las aplicaciones de insecticidas pueden reducir las poblaciones totales de pulgones en un lote de monte frutal y en árboles individuales, pero solo se necesitan uno o unos pocos pulgones portadores de PPV para inocular eficazmente un árbol.
* Hasta ahora se han encontrado algunas fuentes naturales de resistencia al PPV en especies de Prunus, que se están utilizando en programas de reproducción clásicos en algunos países. Se están utilizando diferentes enfoques de ingeniería genética para generar resistencia al PPV, y una variedad transgénica de ciruela denominada «HoneySweet», transformada con el gen viral CP, ha demostrado una alta resistencia al PPV en pruebas de campo en varios países y ha obtenido la aprobación regulatoria en los EE.UU. (García et al., 2014).
.
La principal estrategia de manejo es la prevención: las medidas de control oficial que aplica el SENASA consisten en la erradicación de las plantas enfermas, la obligatoriedad de denuncia de la enfermedad, el control obligatorio de Sharka en las plantas madre de vivero y el control del movimiento de material de propagación del género Prunus en todo el territorio nacional.
ASEGÚRESE DE UTILIZAR MATERIAL SANO Y DE ORIGEN CONOCIDO PARA PLANTAR E INJERTAR.
CUMPLA CON LA NORMATIVA VIGENTE.
A fin de evitar la dispersión de la enfermedad, declara la emergencia fitosanitaria respecto al Sharka y establece lo siguiente:
Se prohíbe el movimiento de todo material vegetal del género Prunus en el territorio nacional sin previa autorización de SENASA.
Los propietarios, poseedores o tenedores de predios donde se presente sintomatología sospechosa de Plum Pox Virus deberán denunciar obligatoriamente su presencia.
La denuncia debe realizarse en forma inmediata y de manera fehaciente o dirigiéndose a la oficina local de SENASA en su zona, aún cuando la sintomatología se presente en una sola rama.
.
Sharka. Normativas vigentes SENASA
.
.
Videos
Plum Pox Virus in Pennsylvania
.
.
.
Bibliografía
Angulo MR (2006) Resistencia a la Sharka (Plum Pox Virus) en especies frutales del género prunus. Tesis doctoral, Universidad Miguel Hernández, Alicante, España. Link
Atanasoff D (1932) Plum pox. A new virus disease. Yearbook University of Sofia, Faculty of Agriculture, 49-69.
Atanasoff D (1935) Mosaic of stone fruits. Phytopathol. Z. 8: 259-284.
Cambra M, Vidal E (2017) Sharka, a vector-borne disease caused by Plum pox virus: vector species, transmission mechanism, epidemiology and mitigation strategies to reduce its natural spread. Acta Hortic. 1163: 57-68. doi: 10.17660/ActaHortic.2017.1163.10
Cirilli M, Geuna F, Babini AR, Bozhkova V, Catalano L, Cavagna B, Dallot S, Decroocq V, Dondini L, Foschi S, Ilardi V, Liverani A, Mezzetti B, Minafra A, Pancaldi M, Pandolfini T, Pascal T, Savino VN, Scorza R, Verde I and Bassi D (2016) Fighting Sharka in Peach: Current Limitations and Future Perspectives. Frontiers in Plant Science 7: 1290. doi: 10.3389/fpls.2016.01290
Clemente-Moreno MJ, Hernández JA, Diaz-Vivancos P (2015) Sharka: how do plants respond to Plum pox virus infection? Journal of Experimental Botany 66(1): 25-35. doi: 10.1093/jxb/eru428
Collum TD, Stone AL, Sherman DJ, et al. (2021) Viral reservoir capacity of wild Prunus alternative hosts of plum pox virus through multiple cycles of transmission and dormancy. Plant Disease. doi: 10.1094/PDIS-04-21-0802-RE
Damsteegt VD, Scorza R, Stone AL, et al. (2007) Prunus Host Range of Plum pox virus (PPV) in the United States by Aphid and Graft Inoculation. Plant Disease 91(1): 18-23. doi: 10.1094/PD-91-0018
De Mori G, Savazzini F, Geuna F (2020) Chapter 10 – Molecular tools to investigate Sharka disease in Prunus species. Editor(s): Palmiro Poltronieri, Yiguo Hong. Applied Plant Biotechnology for Improving Resistance to Biotic Stress. Academic Press. Pages 203-223. doi: 10.1016/B978-0-12-816030-5.00010-0
Decroocq S, Cornille A, Tricon D, et al. (2016) New insights into the history of domesticated and wild apricots and its contribution to Plum pox virus resistance. Mol Ecol. 25(19): 4712-29. doi: 10.1111/mec.13772
Dehkordi et al. (2017) Sharka (Plum pox virus): A forgotten disease in Iran. International Journal of Horticultural Science and Technology 4: 183-191. doi: 10.22059/ijhst.2017.241714.205
Dehkordi AN, Rubio M, Babaeian N, Albacete A, Martínez-Gómez P (2018) Phytohormone Signaling of the Resistance to Plum pox virus (PPV, Sharka Disease) Induced by Almond (Prunus dulcis (Miller) Webb) Grafting to Peach (P. persica L. Batsch). Viruses 10(5): 238. doi: 10.3390/v10050238
Espinoza C, Bascou B, Calvayrac C, Bertrand C (2021) Deciphering Prunus Responses to PPV Infection: A Way toward the Use of Metabolomics Approach for the Diagnostic of Sharka Disease. Metabolites. 11(7): 465. doi: 10.3390/metabo11070465
Hajizadeh M, Gibbs AJ, Amirnia F, Glasa M (2011) The global phylogeny of Plum pox virus is emerging. J. Gen. Virol. 100: 1457–1468. doi:
Gadhave KR, Gautam S, Rasmussen DA, Srinivasan R (2020) Aphid Transmission of Potyvirus: The Largest Plant-Infecting RNA Virus Genus. Viruses 12(7): 773. doi: 10.3390/v12070773
García JA, Glasa M, Cambra M, Candresse T (2014) Plum pox virus. Molecular Plant Pathology 15: 226-241. doi: 10.1111/mpp.12083
Gergerich RC, Dolja VV (2006) Introduction to Plant Viruses, the Invisible Foe. The Plant Health Instructor. doi: 10.1094/PHI-I-2006-0414-01
Glasa M, Prikhodko Y, Predajňa L, et al. (2013) Characterization of sour cherry isolates of plum pox virus from the Volga Basin in Russia reveals a new cherry strain of the virus. Phytopathology 103(9): 972-9. doi: 10.1094/PHYTO-11-12-0285-R
Glasa M, Candresse T (2021) Plum Pox Virus (Potyviridae). Editor(s): Dennis H. Bamford, Mark Zuckerman. Encyclopedia of Virology (Fourth Edition), Academic Press, 586-593. doi: 10.1016/B978-0-12-809633-8.21242-9
Gottwald TR (2006) Epidemiology of sharka disease in North America. EPPO Bulletin 36: 279-286. doi: 10.1111/j.1365-2338.2006.00988.x
Ilardi V and Tavazza M (2015) Biotechnological strategies and tools for Plum pox virus resistance: trans-, intra-, cis-genesis, and beyond. Frontiers in Plant Science 6: 379. doi: 10.3389/fpls.2015.00379
Jevremović D, Paunović SA, Petrović-Obradović O (2016) Flight dynamics and species composition of aphids landing on plum and apricot leaves in the orchards in Western Serbia. Phytoparasitica 44: 501–511. doi: 10.1007/s12600-016-0544-z
Jones RAC (2021) Global Plant Virus Disease Pandemics and Epidemics. Plants 10(2): 233. doi: 10.3390/plants10020233
Kamenova I, Milusheva S, Dragoyski K, et al. (2011) An overview of Sharka research in Bulgaria. Acta Hortic. 899: 19-27. doi: 10.17660/ActaHortic.2011.899.1
Krska B, Vachun Z, Nečas T, Ondrásek I (2015) New Sharka resistant apricots at the horticultural faculty in Lednice. Acta Hortic. 1063, 105-110. doi: 10.17660/ActaHortic.2015.1063.14
Levy L, Damsteegt V, Scorza R, Kolber M (2000) Plum Pox Potyvirus Disease of Stone Fruits. APSnet Features. Online. doi: 10.1094/APSnetFeature-2000-0300
Maejima K, Hoshi H, Hashimoto M, et al. (2010) First report of plum pox virus infecting Japanese apricot (Prunus mume Sieb. et Zucc.) in Japan. Journal of General Plant Pathology 76(3): 229–231. doi: 10.1007/s10327-010-0233-6
Mariette S, Wong Jun Tai F, Roch G, et al. (2016) Genome-wide association links candidate genes to resistance to Plum Pox Virus in apricot (Prunus armeniaca). New Phytol. 209(2): 773-84. doi: 10.1111/nph.13627
Marini D, Farrando R, Porcel L, et al. (2015) Monitoring of plum pox virus concentration at different plant heights throughout the year in prunes (Prunus domestica) in Argentina. Acta Hortic. 1063: 177-183. doi: 10.17660/ActaHortic.2015.1063.25
Martínez‐Turiño S, Pérez JD, Hervás M, et al. (2018) Phosphorylation coexists with O‐GlcNAcylation in a plant virus protein and influences viral infection. Molecular Plant Pathology 19: 1427-1443. doi: 10.1111/mpp.12626
Mori T, Warner C, Ohno S, et al. (2021) Genome sequence analysis of new plum pox virus isolates from Japan. BMC Res Notes 14: 266. doi: 10.1186/s13104-021-05683-9
Nečas T, Göttingerová M, Wolf J, et al. (2020) New promising apricot hybrids from Faculty of Horticulture in Lednice. Acta Hortic. 1290: 169-178. doi: 10.17660/ActaHortic.2020.1290.30
Nemchinov L, Hadidi A (1996) Characterization of the Sour Cherry Strain of Plum Pox Virus. Phytopathology 86: 575-580. doi: 10.1094/Phyto-86-575
Nicaise V (2014) Crop immunity against viruses: outcomes and future challenges. Frontiers in Plant Science 5: 660. doi: 10.3389/fpls.2014.00660
Pennazio S, Roggero P, Conti M (1996) Yield losses in virus‐infected crops. Archives of Phytopathology and Plant Protection 30: 283-296. doi: 10.1080/03235409609383178
Pigliónico D, Ojeda ME, Lucero V, et al. (2021) Spiraea sp. new natural host of Plum pox virus (Sharka). Eur J Plant Pathol 159: 959–962. doi: 10.1007/s10658-021-02206-x
Polák J, Krška B, Komínek P, et al. (2017) A new strategy for the long-term control of Plum pox virus. ISHS Acta Horticulturae 1163: III International Symposium on Plum Pox Virus. doi: 10.17660/ActaHortic.2017.1163.20
Ravelonandro M (2021) Reliable Methodologies and Impactful Tools to Control Fruit Tree Viruses. Crops 1(1): 32-41. doi: 10.3390/crops1010005
Rimbaud L, Dallot S, Delaunay A, et al. (2015) Assessing the Mismatch Between Incubation and Latent Periods for Vector-Borne Diseases: The Case of Sharka. Phytopathology 105(11): 1408–1416. doi: 10.1094/PHYTO-01-15-0014-R
Rimbaud L, Dallot S, Gottwald T, et al. (2015) Sharka epidemiology and worldwide management strategies: learning lessons to optimize disease control in perennial plants. Annual Review of Phytopathology 53: 357–378. doi: 10.1146/annurev-phyto-080614-120140
Rodamilans B, Valli A, García JA (2020) Molecular Plant-Plum Pox Virus Interactions. Mol Plant Microbe Interact. 33: 6-17. doi: 10.1094/MPMI-07-19-0189-FI
Rubio M, Ballester AR, Olivares PM, Castro de Moura M, Dicenta F, Martínez-Gómez P (2015) Gene Expression Analysis of Plum pox virus (Sharka) Susceptibility/Resistance in Apricot (Prunus armeniaca L.). PLoS ONE 10(12): e0144670. doi: 10.1371/journal.pone.0144670
Salvador B, García JA, Simón-Mateo C (2006) Causal agent of sharka disease: Plum pox virus genome and function of gene products. EPPO Bull. 36:229-238.
Salvador B, Delgadillo MO, Sáenz P, García JA, Simón-Mateo C (2008) Identification of Plum pox virus pathogenicity determinants in herbaceous and woody hosts. Mol Plant Microbe Interact. 21: 20-9. doi: 10.1094/MPMI-21-1-0020
Sidorova T, Miroshnichenko D, Kirov I, et al. (2021) Effect of Grafting on Viral Resistance of Non-transgenic Plum Scion Combined With Transgenic PPV-Resistant Rootstock. Front. Plant Sci. 12: 621954. doi: 10.3389/fpls.2021.621954
Sochor J, Babula P, Adam V, et al.(2012) Sharka: the past, the present and the future. Viruses 4(11): 2853-2901. doi: 10.3390/v4112853
Sutic D, Jordovic M, Rankovic M, Festi H (1971) Comparative studies of some sharka virus isolates. Proceedings of the VIII Symposium sur les Maladies a Virus des Arbres Frutiers. Annales de Phytopathologie pp. 185–194.
Tamukong YB, Collum TD, Stone AL, et al. (2020) Dynamic changes impact the plum pox virus population structure during leaf and bud development. Virology 548: 192-199. doi: 10.1016/j.virol.2020.06.014
, , , (2022) High genetic diversity suggests a long evolutionary history of plum pox virus-M in Turkey. Plant Pathology 00, 1– 12. doi: 10.1111/ppa.13663
, , , et al. (2020) Statistical model for Plum pox virus prediction in Prunus nursery blocks using vector and virus incidence data in four different European ecological areas. Ann Appl Biol. 177: 308– 324. doi: 10.1111/aab.12617
Wagemans J, Holtappels D, Vainio E, et al. (2022) Going Viral: Virus-Based Biological Control Agents for Plant Protection. Annu Rev Phytopathol. 60: 21-42. doi: 10.1146/annurev-phyto-021621-114208
Wang A, Sanfaçon H, Stobbs LW, et al. (2006) Plum pox virus in Canada: progress in research and future prospects for disease control, Canadian Journal of Plant Pathology 28: 182-196. doi: 10.1080/07060660609507286
Xing F, Wang HQ, Li SF (2017) Risk assessment of Plum pox virus in China. ISHS Acta Horticulturae 1163: III International Symposium on Plum Pox Virus. doi: 10.17660/ActaHortic.2017.1163.21
, , , et al. (2024) A natural substitution of a conserved amino acid in eIF4E confers resistance against multiple potyviruses. Molecular Plant Pathology 25: e13418. doi: 10.1111/mpp.13418
Zotto AD, Ortego JM, Raigón JM, et al. (2006) First Report in Argentina of Plum pox virus Causing Sharka Disease in Prunus. Plant Disease 90(4): 523. doi: 10.1094/PD-90-0523C
Zotto AD, Porcel LB, Marini DB, et al. (2020) Spatio – temporal spread of Plum pox virus infecting European plum (Prunus domestica L. cv. D’agen) orchard in Mendoza, Argentina. Revista de la Facultad de Ciencias Agrarias Universidad Nacional de Cuyo 52. Link