.
Condición fitosanitaria: Presente
Grupo de cultivos: Leguminosas
Especie hospedante: Haba (Vicia faba), Poroto (Phaseolus vulgaris), Arveja (Pisum sativum)
Etiología: Virus (biotrófico como todos los virus)
Agente causal: Bean yellow mosaic virus (BYMV)
Taxonomía: Viruses > ssRNA viruses > ssRNA positive-strand viruses > no DNA stage > Potyviridae > Potyvirus
Baltimore classification: Group IV: ssRNA(+) Baltimore, 1971
International Committee on Taxonomy of Viruses (ICTV), Potyvirus
NCBI Exemplar accession number
El BYMV es un miembro del género Potyvirus, que posee partículas filamentosas ca. 750 nm de largo, que contiene ca. 5% de ssRNA 9532 nt de tamaño. La detección de BYMV se puede realizar utilizando kits de ELISA disponibles comercialmente, mediante RT-PCR con los pares de primers BYMV fwd 5′-ACA CAA GCA CAG TTT GAA GC-3 ‘y BYMV rev 5′-AGA TCA AGC TCA CAC GAG G-3’, que amplifican un fragmento de 750 pb, y mediante hibridación de transferencia puntual usando una sonda de ADN marcada con DIG (Bariana et al., 1994; Ortiz et al., 2006; Uga, 2005). Se produjeron anticuerpos monoclonales (Jordan and Hammond, 1991) y policlonales (Makkouk et al., 1988) para la detección de BYMV mediante ELISA.
.
.
Antecedentes
Desde el primer reporte de BYMV sobre porotos franceses de los EE.UU. y los Países Bajos en 1925, el virus se extendió por todo el mundo, con una amplia gama de hospedantes que incluye porotos (Phaseolus vulgaris), habas (Vicia faba), lupinos (Lupinus albus L.) y trébol (Trifolium spp) (Wylie et al., 2008), monocotiledóneas y dicotiledóneas como el iris bulboso, lisianthus, genciana, fresias y algunas orquídeas (Kumar et al., 2009). BYMV fue reportado en haba (Vicia faba) por Boning (1927) en Alemania. El virus se detectó en alcachofa o alcaucil (Cynara cardunculus var. scolymus) en Apulia, Italia (Russo y Rana, 1978), y luego en Grecia (Rana y Kyriakopoulou, 1980). Las alcachofas de Apulia también estaban infectadas por BBWV y ArLV y mostraron amarilleamiento de venas, manchas amarillas y patrones de líneas en las hojas. Estos síntomas se parecen mucho a los que caracterizan el «mosaico» etiológicamente indeterminado descrito por Gigante (1951), y el moteado amarillo de Campania y Apulia en Italia con el que se asocia el BBWV (Broad bean wilt virus). En las pruebas de inoculación artificial, un BYMV aislado de alcachofa cv. Castellammare mantenido en el poroto ancho no pudo infectar las plántulas de alcachofa de cvs Mazzaferrata y Vert globo en forma sistémica, pero causó lesiones locales erráticas (Russo y Rana, 1978). Las especies hospedantes de mantenimiento y propagación son Pisum sativum, V. faba, P. vulgaris y N. clevelandii, mientras que C. sativus puede usarse como especie de diagnóstico ya que no está infectada por BYMV. La citopatología de V. faba infectada se ajusta a la inducida por Potivirus (Russo y Rana, 1978).
.
Síntomas
El síntoma de diagnóstico del mosaico amarillo del poroto es el típico mosaico de color amarillo brillante a verde o apariencia de moteado de las hojas infectadas, que se hace más evidente en las hojas a medida que envejecen. Las hojas infectadas también muestran diversos grados de distorsión, ahuecamiento hacia abajo y arrugas. Las plantas infectadas a una edad temprana pueden mostrar retraso en el crecimiento. Aunque los síntomas producidos en respuesta a la infección por BYMV pueden variar según el momento de la infección, la variedad de poroto y la cepa del virus, los síntomas generalmente incluyen arrugas, ahuecamiento hacia abajo, manchas amarillas y áreas muertas a lo largo de las venas de las hojas infectadas. Los síntomas que resultan de la infección BYMV en haba (V. faba) son variables y se ven muy afectados por la cepa del virus y el genotipo de la planta involucrada. En el caso de la arveja, comúnmente conocido como mosaico de la arveja, los síntomas asociados con BYMV incluyen mosaicos y clorosis venosa y la intensidad varía con la cepa. Algunas veces se puede ver necrosis en tallos y venas.
Los llamativos síntomas del mosaico amarillo se diferencian de los del mosaico común del poroto (Bean common mosaic virus, BCMV), el cual causa patrones de mosaico verde claro y verde oscuro de las hojas infectadas. El virus del mosaico amarillo del poroto (BYMV) pertenece a la misma familia de virus que el virus del mosaico común del poroto (BCMV), y ambos virus suelen aparecer en los campos de poroto. Esta superposición puede confundir el diagnóstico, que puede ser particularmente importante en los campos de producción de semillas. Las plantas afectadas con podredumbre de la raíz y el tallo, la toxicidad por manganeso y el tizón bacteriano pueden mostrar algunos síntomas similares a los del virus, por lo que el diagnóstico de laboratorio es aconsejable. A menudo se necesitan pruebas de anticuerpos o ADN para diferenciar entre estos dos virus.
.
.
- 01 Síntomas (mosaico y ampollas) en hoja de soja inoculada con BYMV. Fuente: Campos et al., 2014
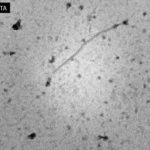
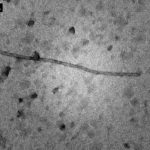
- 02 Partícula filamentosa, flexible, típica de Potivirus vistos bajo microscopio electrónico en preparaciones de inmersión. Fuente: Campos et al., 2014
- 03 Síntomas causados en planta de haba (V. faba) por BYMV. Autor: Ing. Agr. Pablo Reyna, INTA IPAVE
- 04 Síntomas causados en planta de haba (V. faba) por BYMV. Autor: Ing. Agr. Pablo Reyna, INTA IPAVE
- 05 Síntomas causados en planta de haba (V. faba) por BYMV. Autor: Ing. Agr. Pablo Reyna, INTA IPAVE
- 06 Síntomas causados en planta de haba (V. faba) por BYMV. Autor: Ing. Agr. Pablo Reyna, INTA IPAVE
- 07 Síntomas causados en planta de haba (V. faba) por BYMV. Autor: Ing. Agr. Pablo Reyna, INTA IPAVE
- 08 Síntomas causados en planta de haba (V. faba) por BYMV. Autor: Ing. Agr. Pablo Reyna, INTA IPAVE
- 09 SEM de partícula del virus BYMV. Autor: CIAP-INTA
- 10 SEM de partícula del virus BYMV. Autor: CIAP-INTA
- 11 SEM de partícula del virus BYMV. Autor: CIAP-INTA
.
Epidemiología
El BYMV tiene un amplio rango de hospedantes leguminosas y puede invernar fácilmente en cultivos de leguminosas (como por ejemplo alfalfa, trébol, Vicia), malezas y gladiolos. El virus es transmitido por más de 20 especies de áfidos de manera no persistente. La transmisión del virus a la planta de poroto ocurre en cuestión de segundos una vez que los áfidos portadores del virus comienzan a alimentarse del cultivo. Los áfidos pueden propagar eficazmente el virus dentro de un campo, lo que da como resultado altas tasas de infección.
Si bien el virus también se transmite a través de la semilla de la mayoría de las legumbres templados (Sasaya et al., 1993), no se sabe si el virus es transmitido por semillas de poroto.
.
Manejo Integrado
Sembrar los campos de poroto tan lejos de otras leguminosas (alfalfa, trébol, arveja) y campos de gladiolos como sea posible. Los insecticidas generalmente no son efectivos en reducir la velocidad de propagación del virus por áfidos.
.
.
.
Bibliografía
Alani R, Adhab MA (2013) Bean Yellow Mosaic Virus (BYMV) on Broadbean: Characterization and Resistance Induced by Rhizobium leguminosarum. Journal of Pure and Applied Microbiology 7(1): 135-142.
Alkhalaf M, Kumari SG, Haj Kasem A, Makkouk KM, Al-Chaabi S (2010) Bean yellow mosaic virus on cool-season food legumes and weeds: Distribution and its effect on faba bean yield and control in Syria. Arab J. Plant Prot. 28:38–47.
Barakat A, Torky ZA (2017) Molecular Detection of Bean Yellow Mosaic Virus in Lupinus albus Plants and its Associated Alterations in Biochemical and Physiological Parameters. J Antivir Antiretrovir 9: 033-042. doi: 10.4172/1948-5964.1000159
Bariana HS, Shannon AL, Chu PWG, Waterhouse PM (1994) Detection of five seedborne legume viruses in one sensitive multiplex polymerase chain reaction test. Phytopathology 84: 1201–1205. doi: 10.1094/Phyto-84-1201
Boning K (1927) Die Mosaikkrankheit der Ackerbohne (Vicia faba). Forsch. Geb. Pflzkrkh. Immunita¨t Pflanzenr 4:43–111.
Bos L (1970) Bean yellow mosaic virus. CMI/AAB Descriptions of Plant Viruses No. 40.
Campos RE, Bejerman N, Nome C, Laguna IG, Rodríguez Pardina P (2014) Bean Yellow Mosaic Virus in Soybean from Argentina. Journal of Phytopathology 162: 322-325. doi: 10.1111/jph.12185
Eldin ASG, El-Kady MA, El-Amrety AA (1981) Pea mosaic virus (PMV) strain of bean yellow mosaic virus isolated from pea. Egypt. J. Phytopathol. 13: 23–28.
Kahattb EA, Morsy M, Al-shamran IM (2015) Observation of Mitotic and Cytological Effects Induced by Bean Yellow Mosaic Virus in Affecting Leguminous Plants. International Journal of Virology 11: 123-132. doi: 10.3923/ijv.2015.123.132
Ghad IPS, Bernier CC (1984) Resistance in faba bean (Vicia faba) to bean yellow mosaic virus. Plant Disease 68: 109–111.
Guerret MG, Barbetti MJ, You MP, Jones RA (2016) Effects of Temperature on Disease Severity in Plants of Subterranean Clover Infected Singly or in Mixed Infection with Bean yellow mosaic virus and Kabatiella caulivora. Journal of Phytopathology 164: 608-619. doi: 10.1111/jph.12484
Habib SA, El-Atta OK, El-Hammady M, Awad M (1981) Interaction between bean common mosaic virus and bean yellow mosaic virus in relation to morphological characters of bean plants (Phaseolus vulgaris). Res. Bull. Fac. Agric. Ain Shams Univ. 1606: 1–14.
Hammond J, Hammond RW (1989) Molecular cloning, sequencing and expression in Escherichia coli of the bean yellow mosaic virus coat protein gene. Journal of General Virology 70: 1961–1974. doi: 10.1099/0022-1317-70-8-1961
Hosseini A, Hosseini S (2014) Occurrence and Distribution of Bean common mosaic virus and Bean yellow mosaic virus from common bean fields of Kerman province, Iran. Indian Journal of Fundamental and Applied Life Sciences 4(2): 528-535. ISSN: 2231-6345 (Online)
Jordan R, Hammond J (1991) Comparison and differentiation of potyvirus isolates and identification of strain-, virus-, subgroup-specific and potyvirus group-common epitopes using monoclonal antibodies. Journal of General Virology 72: 25–36. doi: 10.1099/0022-1317-72-1-25
Kaur C, Kumar S, Raj SK (2013) New Record of Association of Bean yellow mosaic virus with Mosaic Disease of Vicia faba in India. Indian Journal of Virology 24(1): 95-96. doi: 10.1007/s13337-013-0128-1
Kaur C, Raj R, Kumar S, Raj S (2014) First report of Bean yellow mosaic virus on Cape gooseberry in India. New Disease Reports 29: 17. doi: 10.5197/j.2044-0588.2014.029.017
Kaur C, Kumar S, Raj SK, Chauhan PS, Sharma N (2015) Characterization of a new isolate of Bean yellow mosaic virus Group-IV Associated with Mosaic disease of Gladiolus in India. J Plant Pathol Microb 6: 309. doi: 10.4172/2157-7471.1000309
Kaur C, Raj R, Srivastava A, et al. (2018) Sequence analysis of six full-length bean yellow mosaic virus genomes reveals phylogenetic diversity in India strains, suggesting subdivision of phylogenetic group-IV. Archives of Virology 163(1): 235–242. doi: 10.1007/s00705-017-3609-5
Kumari A, Kaur C, Kumar S, et al. (2015) First Report of Bean yellow mosaic virus Causing a Mosaic Disease of Canna sp. in India. Plant Disease 99(6): 897-897. doi: 10.1094/PDIS-01-15-0001-PDN
Mai TLT, Xuan TVT, Hoang DL, et al. (2016) RNAi-mediated resistance to SMV and BYMV in transgenic tobacco. Crop Breed. Appl. Biotechnol. 16(3): 213-218. doi: 10.1590/1984-70332016v16n3a32
Maina S, Zheng L, King S, et al. (2020) Genome Sequence and Phylogeny of a Bean Yellow Mosaic Virus Isolate Obtained from a 14-Year-Old Australian Lentil Sample. Microbiol Resour Announc. 9(2): e01437-19. doi: 10.1128/MRA.01437-19
Makkouk KM, Lesemann DE, Haddad NA (1982) Bean yellow mosaic virus from broad bean in Lebanon: Incidence, host range, purification, and serological properties. Journal of Plant Diseases and Protection 89: 59–66.
Makkouk KM, Katul L, Rizkallah A (1988) A Simple Procedure for the Purification and Antiserum Production of Bean Yellow Mosaic Virus. Journal of Phytopathology 122: 89-93. doi: 10.1111/j.1439-0434.1988.tb00993.x
McKirdy SJ, Coutts BA, Jones RAC (1994) Occurrence of bean yellow mosaic virus in subterranean clover pastures and perennial native legumes. Australian Journal of Agricultural Research 45(1): 183-194. doi: 10.1071/AR9940183
Ortiz V, Navarro E, Castro S, Carazo G, Romero J (2006) Incidence and transmission of Faba bean necrotic yellows virus (FBNYV) in Spain. Spanish Journal of Agricultural Research 4: 255–260. doi: 10.5424/sjar/2006043-200
Raizada RK, Aslam M, Singh BP (1991) Immunological detection of bean yellow mosaic virus in seeds of faba bean (Vicia faba L.). Indian Journal of Virology 7: 179–183.
Rana GL, Kyriakopoulou PE (1981) Bean yellow mosaic virus in artichokes in Greece. Proceedings of the Fifth Congress of the Mediterranean Phytopathological Union, Patras, Greece, 21-27 September 1980. Hellenic Phytopathological Society. Athens Greece, pp. 38–40.
Russo M, Gallitelli D, Vovlas C, Savino V (1984) Properties of broad bean yellow band virus, a possible new tobravirus. Ann. Appl. Biol. 105:223–230.
Saiz M, Castro S, Carazo G, Romero J, de Blas C (1993) First report of bean yellow mosaic virus in Spain. Plant Dis. 77:429. doi: 10.1094/PD-77-0429E
Sasaya T, Iwasaki M, Yamamoto T (1993) Seed transmission of bean yellow mosaic virus in broad bean (Vicia faba). Ann. Phytopathol. Soc. Jpn. 59: 559–562.
Schulze A, Roberts R, Pietersen G (2017) First Report of the Detection of Bean yellow mosaic virus (BYMV) on Tropaeolum majus; Hippeastrum spp., and Liatris spp. in South Africa. Plant Disease 101(5): 846. doi: 10.1094/PDIS-10-16-1446-PDN
Shagrun M (1973) Bean yellow mosaic virus on broad bean plants in Libya. Identification of the causal agent. Libyan J. Agric. 11: 33–38.
Sharma PN, Sharma V, Sharma A, Rajput K, Sharma SK (2015) Identification and molecular characterization of Bean yellow mosaic virus infecting French bean in Himachal Pradesh. VirusDisease 26(4): 315–318. doi: 10.1007/s13337-015-0270-z
Swenson KG (1957) Transmission of Bean Yellow Mosaic Virus by Aphids. Journal of Economic Entomology 50(6): 727–731. doi: 10.1093/jee/50.6.727
Uga H (2005) Use of crude sap for one-step RT-PCR-based assays of Bean yellow mosaic virus and the utility of this protocol for various plant-virus combinations. Journal of General Plant Pathology 71: 86–89. doi: 10.1007/s10327-004-0166-z
Vovlas C, Russo M (1978) Virus disease of vegetable crops in Apulia. XXII. Bean yellow mosaic virus in broad bean. Phytopath. Medit. 17: 201–204.
Wada Y, Iwai H, Ogawa Y, Arai K (2000) Comparison of pathogenicity and nucleotide sequences of 3′-terminal regions of bean yellow mosaic virus isolates from Gladiolus. Journal of General Plant Pathology 66: 345-352. doi: 10.1007/PL00012976
Wagemans J, Holtappels D, Vainio E, et al. (2022) Going Viral: Virus-Based Biological Control Agents for Plant Protection. Annu Rev Phytopathol. 60: 21-42. doi: 10.1146/annurev-phyto-021621-114208
Wylie SJ, Coutts BA, Jones MGK, Jones RAC (2008) Phylogenetic Analysis of Bean yellow mosaic virus Isolates from Four Continents: Relationship Between the Seven Groups Found and Their Hosts and Origins. Plant Disease 92(12): 1596-1603. doi: 10.1094/PDIS-92-12-1596
Younis HA, Shagrun M, Khalil J (1992) Isolation of bean yellow mosaic virus from broad bean plants in Libya. Libyan J. Agric. 13: 165–170.
, , , et al. (2024) A natural substitution of a conserved amino acid in eIF4E confers resistance against multiple potyviruses. Molecular Plant Pathology 25: e13418. doi: 10.1111/mpp.13418