.
Condición fitosanitaria: Plaga Cuarentenaria Ausente
Grupo de cultivos: Cereales
Especie hospedante: Maíz (Zea mays)
Rango de hospedantes: maíz
Etiología: Bacteria. Gram positiva
Agente causal: Clavibacter nebraskensis; syn Clavibacter michiganensis subsp. nebraskensis corrig. (Vidaver and Mandel 1974) Davis et al. 1984
Taxonomía:
Bacteria > Terrabacteriagroup > Actinobacteria > Actinobacteria > Micrococcales > Microbacteriaceae > Clavibacter
Cmsn es una bacteria Gram positiva, corineforme, aeróbica, no formadora de esporas de la familia Microbacteriaceae de Actinobacteria. C. michiganensis es la única especie actualmente reconocida dentro del género; y sus seis subespecies (subspp. insidiosus, michiganensis, nebraskensis, phaseoli, sepedonicus y tesselarius) son patógenos de plantas.
Un análisis reciente de todo el genoma y tipificación multilocus de secuencias de la subespecie de Clavibacter michiganensis dio como resultado una recomendación para reclasificar las siete subespecies en dos nuevas especies y tres nuevas combinaciones (Li et al., 2018). Como resultado de esta reclasificación propuesta, C. michiganensis subsp. nebraskensis se considera una nueva especie, a saber, C. nebraskensis.
.
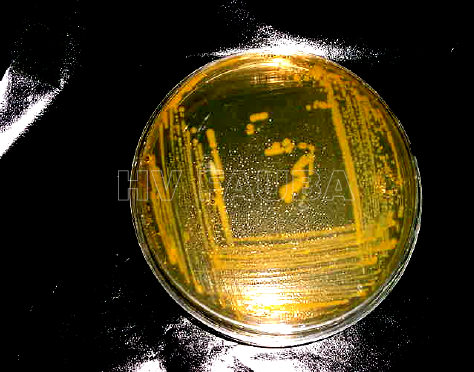
- Colonias bacterianas de Clavibacter michiganensis subsp. nebraskensis en medio KB. Autor: Ayala Labarrios et al 2004.
.
Antecedentes
En 1969, Clavibacter michiganensis subsp. nebraskensis se informó por primera vez en Nebraska, USA, y pronto apareció en los estados adyacentes productores de maíz (Vidaver et al., 1981).
A partir de 2006, después de casi 30 años de ser una preocupación menor, el número de brotes de la enfermedad aumentó drásticamente y el patógeno se expandió a nuevas áreas de EE.UU. y Canadá (Jackson et al., 2007; Langemeier et al., 2017).
En Canadá, la enfermedad de Goss fue confirmada por primera vez en 2009 en Manitoba (Desjardins, 2010). Se extendió rápidamente a otras partes de la provincia, y en 2011 se encontró en el 83% de los 270 campos de maíz encuestados, aunque a niveles no epidémicos (H. Derksen, sin publicar). La enfermedad se informó posteriormente por primera vez en Alberta en 2013 (Howard et al., 2015).
El impacto económico en el cultivo puede variar con la severidad de la enfermedad. Por ejemplo, cuando se evaluaron áreas con alta severidad (más del 5% del área foliar afectada) en el medio oeste de EE. UU., el peso de mil granos se redujo significativamente, pero estas reducciones no se observaron en parcelas con menor gravedad (menos del 5% área foliar afectada) (Robertson et al., 2012).
.
Síntomas
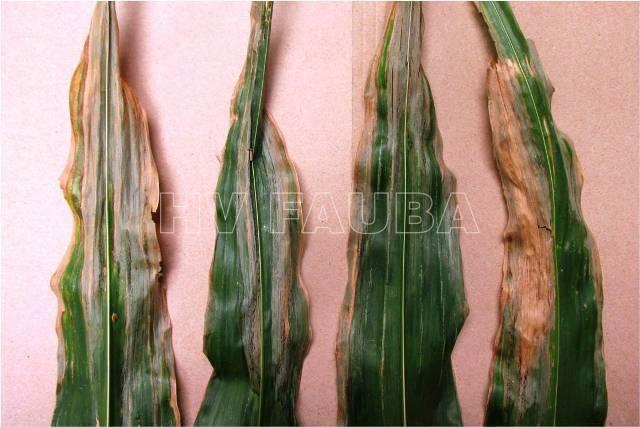
Una vez que Clavibacter nebraskensis penetra en las hojas susceptibles del hospedante, se multiplica y causa un tizón foliar que se presenta como lesiones oscuras, empapadas de agua (water soaked) y con rayas a lo largo de las nervaduras de las hojas. Las lesiones son a menudo más notables a partir de R1 (emergencia de los estigmas). Se pueden ver «pecas» oscuras y de forma irregular dentro de las áreas empapadas de agua a lo largo de las estrías de las hojas y son características de la enfermedad (Fig. 1). Pueden ocurrir quemaduras en la hoja, especialmente en la punta y / o margen de la hoja, lo que se manifiesta como tizón foliar. Además, los exudados bacterianos en la superficie de las hojas a menudo se secan, formando un brillo o apariencia «barnizada» en hojas sintomáticas (Claflin, 1999). Las plantas con infecciones sistémicas muestran síntomas de marchitez macroscópica externa que incluye el quemado de las hojas, particularmente en los márgenes y las puntas (Fig. 1); y en los casos severos, las plantas se secan y marchitan (Claflin 1999). Los síntomas de marchitez vascular pueden confundirse fácilmente con los del estrés por sequía. Puede aparecer un tono anaranjado en las vainas y los granos. Un signo interno de la fase de marchitez puede incluir la decoloración anaranjada de los haces vasculares y el exudamiento bacteriano de los tejidos infectados (grandes poblaciones de bacterias que emanan de la superficie cortada del tejido vegetal infectado). Los síntomas pueden desarrollarse en cualquier etapa del crecimiento de la planta, pero generalmente son más pronunciados cuando las condiciones secas y cálidas se vuelven extremas. Las plantas jóvenes infectadas pueden morir prematuramente, mientras que las plantas más viejas pueden no alcanzar la altura normal y pueden no formar espigas o panojas, y / o experimentar un relleno de grano reducido.
.
- 01 Síntomas del marchitamiento y tizón foliar bacteriano de Goss en maíz causado por Clavibacter nebraskensis. A) Quemaduras marginales y generales de las hojas superiores debido a la fase de marchitamiento, y síntomas de la fase del tizón de la hoja en las hojas inferiores,, bajo condiciones de campo. B) Lesiones «empapadas en agua» (water soaked), inicialmente paralelas a las nervaduras de la hoja, y luego se unen. También se observa abrasión de las hojas, particularmente en los márgenes y puntas. C) «Pecas» oscuras y de forma irregular dentro de las áreas tipo «water soaking». D) Corte transversal de un tallo de maíz con la fase de marchitamiento de Goss. El exudado color naranja / amber de los haces vasculares es un signo del patógeno bacteriano que coloniza fuertemente el xilema. Autor: Harding et al., 2018.
- 02 Síntomas foliares del Marchitamiento y Tizón foliar bacteriano de Goss en maíz. Autor: Vikram Bisht, MAFRD
- 03 Síntomas foliares del Marchitamiento y Tizón foliar bacteriano de Goss en maíz. Autor: Purdue Extension Entomology, Purdue University
..
.
Condiciones predisponentes
La bacteria puede crecer dentro de un rango de temperatura relativamente amplio, entre 12°C a 40°C, pero en estos extremos fríos o calientes, se producirá un crecimiento lento o incluso la muerte del patógeno (Claflin 1999). Las condiciones ideales para el desarrollo de la enfermedad son alta humedad y ~27°C.
Los factores agronómicos que fueron los principales predictores de una mayor detección de marchitamiento de Goss, en orden de importancia, incluyen: monocultivo de maíz o rotaciones con cultivos no hospedantes, fecha de siembra, mayor porcentaje de cobertura de residuos, mayor rendimiento promedio histórico, reducción o falta de laboreo, mayor contenido de nitrógeno presiembra, mayor riego por pivote central, monitoreo antes de la etapa de crecimiento R1.
.
Epidemiología
Se ha demostrado que el patógeno infecta el grano y, por lo tanto, se transmite por semilla. Sin embargo, los ejemplos de transmisión de semillas son muy raros. Lo más probable es que las bacterias invernan en los residuos culturales, que luego proporcionan el inóculo primario. La bacteria sobrevive menos de dos semanas en el suelo, pero puede sobrevivir en residuos de cultivos durante 10 meses o más (Schuster 1975). Como resultado, la mayoría de las infecciones de campo a gran escala se inician por inóculo a partir de residuos de maíz infectados.
Es posible que C. nebraskensis pueda sobrevivir en hospedantes alternativos o malezas, pero las investigaciones han revelado un rango de hospedantes relativamente pequeño en condiciones de campo. Además de todos los tipos o variantes de maíz (Zea mays) que se comercializan (maíz dentado, maíz dulce, híbridos para palomitas de maíz (popcorn) y maíz de ensilaje o pastoreo), se han confirmado otros hospedantes. Si bien el papel exacto de estos hospedantes alternativos en las epidemias de enfermedades no es bien conocido, está claro que pueden ser reservorios u hospedantes de hibernación para la bacteria. Las inoculaciones con C. nebraskensis han resultado en infección en los siguientes hospedantes: Tripsacum dactyloides, Digitaria sanguinalis, Lolium multiflorum, Sorghum bicolor, Sorgo halepense, Setaria viridis, S. faberi, S. verticillata, S. pumila, Saccharum officinarum, Euchlaena (syn. Zea) mexicana (Schuster, 1975; Claflin, 1999; Ilkey et al., 2015; Langemeier et al., 2014).
.
La marchitez de Goss es principalmente una enfermedad transmitida por residuos, pero en casos muy raros, el patógeno puede ser transmitido por semillas. La transmisión de semillas como mecanismo de introducción de patógenos es improbable, pero no puede descartarse especialmente en híbridos de maíz muy susceptibles. Biddle (1990) demostró que la transmisión del patógeno de la semilla a la plántula se producía a una tasa extremadamente baja. La posibilidad de infección de semilla a plántula se demostró usando semilla inoculada, pero se produjo a una tasa extremadamente baja de 0.1% a 0.4%. Resultados similares fueron observados por Robertson et al. (2012) donde se encontró menos de 1% de infección de semilla, incluso en parcelas con altas presiones de enfermedad.
Las nuevas infecciones generalmente comienzan con lesiones causadas por el viento, la arena, la lluvia o el granizo, por lo que es común que las epidemias graves o generalizadas sigan a eventos climáticos severos. Un estudio de Eggenberger et al. (2016) confirmó que la principal fuente de inóculo primario proviene de los residuos de maíz infectados y que las infecciones se mueven más rápidamente a través de los rodales de maíz inoculados con heridas en comparación con los rodales de maíz no heridos inoculados con residuos de maíz infectados. Además, el estudio demostró que las poblaciones epífitas en plantas asintomáticas eran el resultado de un inóculo primario en residuos de maíz que podía diseminarse gradualmente, pasando desapercibido mientras se propagaba a nuevas áreas a través de residuos o aerosoles arrastrados por el viento (Eggenberger et al., 2016). También es posible el movimiento pasivo hoja a hoja de las poblaciones epífitas cuando las hojas infectadas entran en contacto con las hojas no infectadas. Por lo tanto, aunque los eventos de tormenta juegan un papel clave en el movimiento o la introducción del patógeno, es posible que no siempre provoquen brotes importantes o repentinos, sino que muevan el patógeno a nuevas áreas en las que la enfermedad puede acumularse inadvertidamente durante temporadas sucesivas. Los niveles dañinos pueden aparecer cuando existen hospedantes susceptibles y condiciones ambientales propicias.
Los residuos de maíz infectados como la principal fuente de inóculo resaltan el riesgo de brotes severos de la Marchitez de Goss en los sistemas de monocultivo de maíz. Cuando se siembra un nuevo cultivo de maíz sobre residuos de maíz infectado por marchitez de Goss, existe un riesgo grave de pérdida de rendimiento, especialmente en el caso de híbridos susceptibles.
C. nebraskensis a menudo aprovecha los tejidos heridos como punto de entrada del hospedante, pero también puede ingresar a las hojas a través de las aberturas naturales (Mallowa et al., 2016). Si bien la entrada a través de aberturas naturales, como los estomas y los hidatodos, puede agravar la enfermedad en los campos infectados, normalmente no es el principal medio por el cual se originan los brotes epidémicos. Se ha observado que la bacteria coloniza las hojas de maíz en las uniones de células epidérmicas, depresiones de la cutícula, bases de tricomas y en y alrededor de los estomas (Mallowa et al., 2016). Una vez que C. nebraskensis penetra en las hojas susceptibles del hospedante, se multiplica y causa síntomas. Una vez que los tejidos de maíz susceptibles son invadidos a través de heridas o aberturas, y las condiciones ambientales adecuadas (alta humedad y ~ 27 ° C) están presentes, C. nebraskensis puede colonizar rápidamente las hojas. La bacteria puede moverse sistémicamente por movimiento pasivo a través del xilema. Una vez dentro del xilema, un exudado puede observarse en las superficies de las hojas y propagarse localmente a las plantas adyacentes a través del contacto directo o salpicaduras de gotas de agua de lluvia o riego. Como resultado de esta diseminación localizada, las plantas sintomáticas ocurren frecuentemente en grupos en o cerca del sitio de infección inicial (Eggenberger et al., 2016).
.
Manejo Integrado
* Híbridos resistentes o tolerantes. Se han encontrado fuentes de resistencia genética (Mehl et al., 2021)
* Rotación de cultivos. Debido a que la Clavibacter nebraskensis no sobrevive durante largos períodos en el suelo y normalmente no es transmitida por la semilla, la rotación de cultivos puede ser un método muy efectivo para controlar la marchitez de Goss (Claflin, 1999). Las poblaciones bacterianas en los residuos de cultivos infectados disminuyen significativamente después de 10 meses (Schuster, 1975), lo que hace que la rotación con cultivos no hospedantes sea una poderosa herramienta de manejo.
La medida de manejo más importantes para el control de la marchitez de Goss es la siembra de híbridos resistentes, la rotación con cultivos no hospedantes y la eliminación o incorporación del inóculo primario (Langemeier et al., 2017)
.
.
Bibliografía
Ayala Labarrios LA, Rodríguez Herrera R, Aguilar González CN, Lara Victoriano F, Quero Carrillo AR (2004) Detección de Clavibacter michiganensis subsp. nebraskensis (Schuster, Hoff, Mandel y Lazar) Vidaver y Mandel, usando la reacción en cadena de la polimerasa. Revista Mexicana de Fitopatología 22(2): 239-245. LINK
Biddle JA (1990) Epidemiology and seed transmission of Goss’s bacterial wilt and blight in corn. Iowa State University [PhD dissertation]. Ames (IA): Iowa State University.
Claflin LE (1999) Goss’s bacterial wilt and blight. In: White DG, editor. Compendium of Corn Diseases, 3rd edition. St. Paul (MN): APS Press. p. 4–5.
Desjardins ML (2010) 2009 Manitoba crop diagnostic centre laboratory submissions. Can Plant Dis Surv. 90: 20-27.
Eggenberger S, Diaz-Arias MM, Gougherty AV, Nutter Jr FW, Sernett J, Robertson AE (2016) Dissemination of Goss’s wilt of corn and epiphytic Clavibacter michiganensis subsp. nebraskensis from inoculum point sources. Plant Disease 100: 686-695. doi: 10.1094/PDIS-04-15-0486-RE
Eichenlaub R, Gartemann KH (2011) The Clavibacter michiganensis Subspecies: Molecular Investigation of Gram-Positive Bacterial Plant Pathogens. Annual Review of Phytopathology 49: 445-464. doi: 10.1146/annurev-phyto-072910-095258
Howard RJ, Harding MW, Lynn J, Kawchuk LM, Rasmussen NM (2015) First report of Goss’s bacterial wilt and leaf blight on corn caused by Clavibacter michiganensis subsp. nebraskensis in Alberta, Canada. Plant Disease 99: 1034-1034. doi: 10.1094/PDIS-11-14-1117-PDN
Ikley JT, Wise KA, Johnson WG (2015) Annual ryegrass (Lolium multiflorum), Johnsongrass (Sorghum halepense), and large crabgrass (Digitaria sanguinalis) are alternative hosts for Clavibacter michiganensis subsp. nebraskensis, causal agent of Goss’s wilt of corn. Weed Science 63: 901-909. doi: 10.1614/WS-D-15-00028.1
Jackson TA, Harveson RM, Vidaver AK (2007) Reemergence of Goss’s wilt and blight of corn to the central High Plains. Plant Health Progress (online). doi: 10.1094/PHP-2007-0919-01-BR
Langemeier CB, Jackson-Ziems TA, Kruger GR (2014) Four common Setaria species are alternative hosts for Clavibacter michiganensis subsp. nebraskensis, causal agent of Goss’s bacterial wilt and blight of corn. Plant Health Progress (online). doi: 10.1094/PHPRS-12-0160
Langemeier CB, Robertson AE, Wang D, Jackson-Ziems TA, Kruger GR (2017) Factors affecting the development and severity of Goss’s bacterial wilt and leaf blight of corn, caused by Clavibacter michiganensis subsp. nebraskensis. Plant Disease 101: 54-61. doi: 10.1094/PDIS-01-15-0038-RE
Li X, Tambong J, Yuan KX, et al. (2018) Re-classification of Clavibacter michiganensis subspecies on the basis of whole-genome and multi-locus sequence analyses. International Journal of Systematic and Evolutionary Microbiology 68: 234-240 doi: 10.1099/ijsem.0.002492
Harding MW, Jindal K, Tambong JT, Daayf F, Howard RJ, Derksen H, Reid LM, Tenuta AU, Feng J (2018) Goss’s bacterial wilt and leaf blight of corn in Canada – disease update. Canadian Journal of Plant Pathology (Accepted). doi: 10.1080/07060661.2018.1506502
Mallowa SO, Mbofung GY, Eggenberger SK, Den Adel RL, Scheiding SR, Robertson AE (2016) Infection of maize by Clavibacter michiganensis subsp. nebraskensis does not require severe wounding. Plant Disease 100: 724-731. doi: 10.1094/PDIS-08-15-0923-RE
Malvick D, Syverson R, Mollov D, Ishimaru CA (2010) Goss’s Bacterial Blight and Wilt of Corn Caused by Clavibacter michiganensis subsp. nebraskensis Occurs in Minnesota. Plant Dis. 94(8): 1064. doi: 10.1094/PDIS-94-8-1064A
Mehl KM, Mikel MA, Bradley CA (2021) Evaluation of Corn Germplasm Accessions for Resistance to Clavibacter nebraskensis, Causal Agent of Goss’s Bacterial Wilt and Leaf Blight. Plant Disease 105(1): 156-163. doi: 10.1094/PDIS-11-19-2394-RE
Osdaghi E, Robertson AE, Jackson-Ziems T, et al. (2022) Clavibacter nebraskensis causing Goss’s wilt of maize: five decades of detaining the enemy in the new world. Molecular Plant Pathology. doi: 10.1111/mpp.13268
Robertson AE, Block CC, Hurburgh CR, Shepherd LM (2012) Effect of Goss’s leaf blight severity on grain quality and on Clavibacter michiganensis subsp. nebraskensis seed infection. Phytopathology 102: 101-102. LINK
Schuster ML (1975) Leaf freckles and wilt of corn incited by Corynebacterium nebraskense Schuster, Hoff, Mandel, Lazar, 1972. Research Bulletin No. 270. The Agricultural Experimental Station, IANR, University of Nebraska-Lincoln.
Vidaver AK, Gross DC, Wysong DS, Doupnik Jr, BL (1981) Diversity of Corynebacterium nebraskense strains causing Goss’s bacterial wilt and blight of corn. Plant Disease 65: 480-483.
Xu X, Kumar A, Deblais L, et al. (2015) Discovery of novel small molecule modulators of Clavibacter michiganensis subsp. michiganensis. Frontiers in Microbiology 6: 1127. doi: 10.3389/fmicb.2015.01127
Xu R, Adam L, Chapados J, et al. (2021) MinION Nanopore-based detection of Clavibacter nebraskensis, the corn Goss’s wilt pathogen, and bacteriomic profiling of necrotic lesions of naturally-infected leaf samples. PLoS ONE 16(1): e0245333. doi: 10.1371/journal.pone.0245333