.
Condición fitosanitaria: Plaga Cuarentenaria Ausente
Grupo de cultivos: Frutales de pepita
Especie hospedante: Peral (Pyrus communis), Manzano (Malus domestica)
Etiología: Bacteria. Gram negativa. Considerada hemibiotrófica (*)
Agente causal: Erwinia amylovora (Burrill 1882) Winslow et al. 1920 (AL 1980) emend. Hauben et al. 1999
Taxonomía: Bacteria > Proteobacteria > Gammaproteobacteria > Enterobacterales > Erwiniaceae > Erwinia
E. amylovora es una bacteria gram negativa, con forma de bastón corto, con extremos redondeados, móviles por muchos flagelos peritrícos.
(*) Sin embargo, también se ha demostrado experimentalmente que E. amylovora tiene la capacidad de sobrevivir como semi-necrotrófico o necrotrófico, lo que le permite pasar el invierno en las hojas muertas de manzano (Sobiczewski et al., 2017).
.
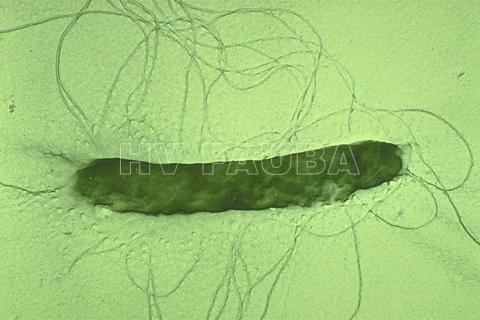
- Las células de E. amylovora son gram negativas, en forma de bastoncillo, miden 0.5-1.0 x 3.0 uM y están flageladas en todos los lados (perítricos). Autor: Johnson, APS
.
.
.
Antecedentes
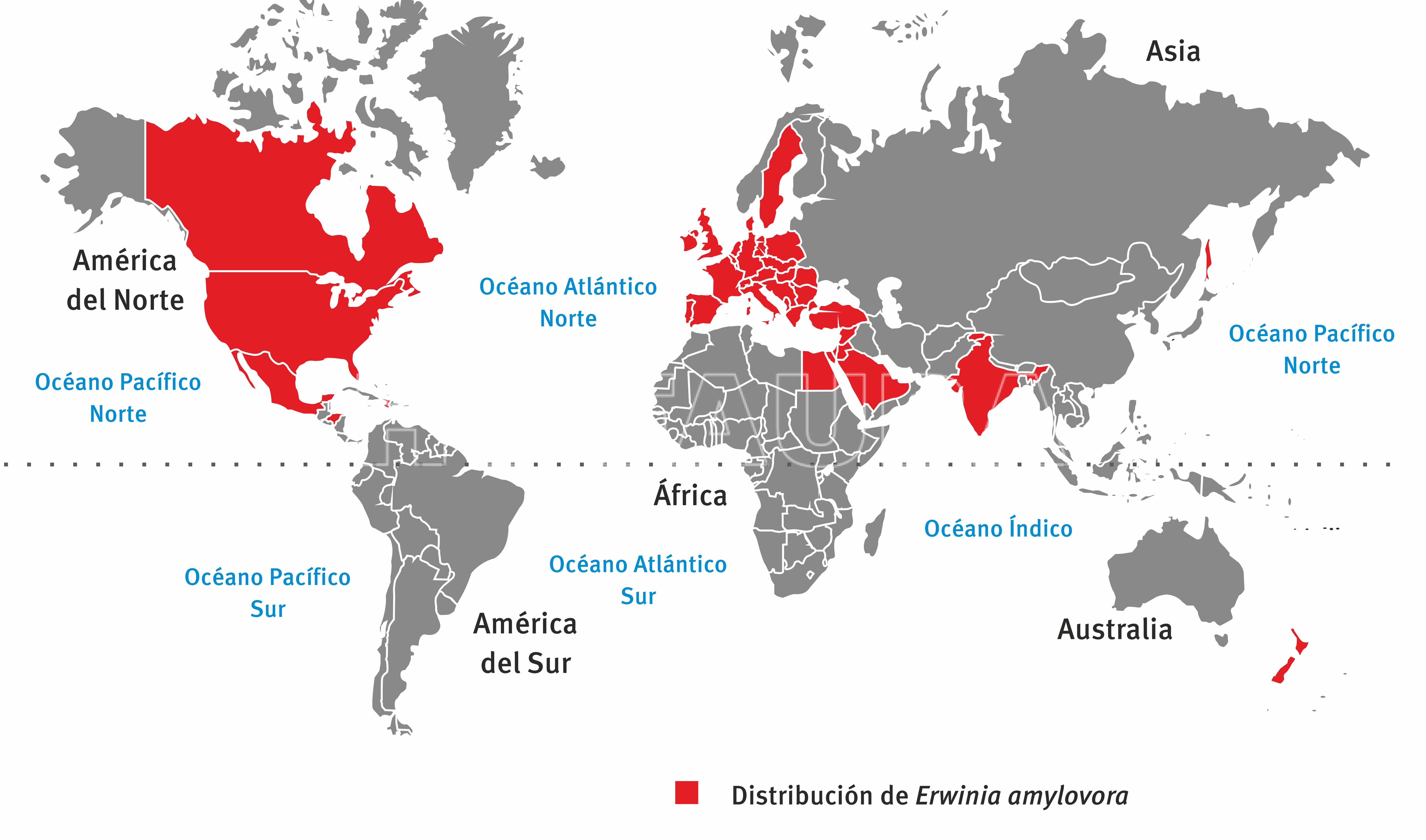
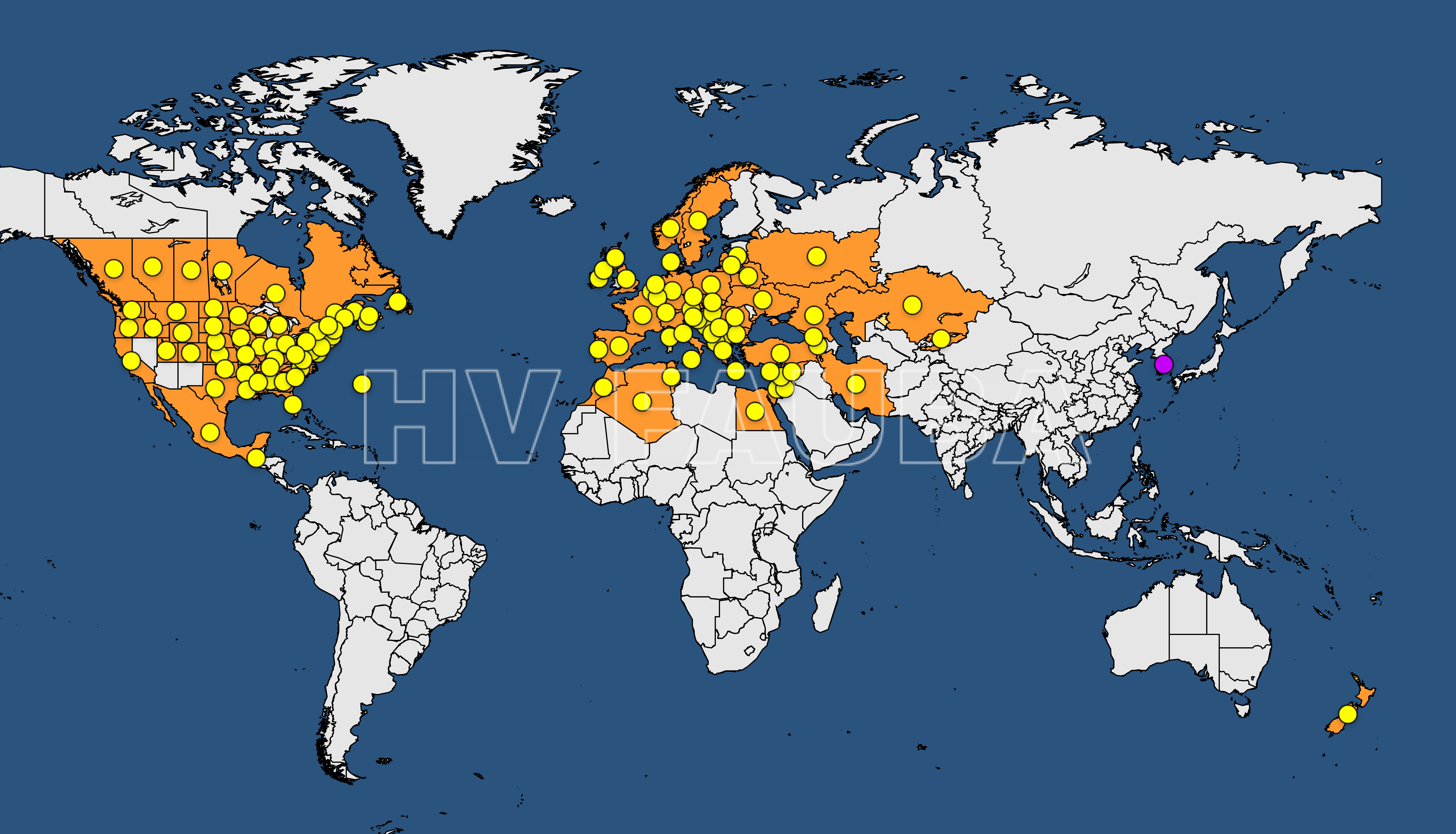
Además de la importancia histórica de ser la primera bacteria para la que se comprobó ser patógena para plantas, es extremadamente importante desde el punto de vista económico en los países en que la enfermedad es endémica. Por ejemplo, en Estados Unidos los costos de control y las pérdida se estiman en aproximadamente u$s 100 millones por año. Esta enfermedad fue descripta por primera vez en el año 1789, en proximidades de la ciudad de Nueva York (Estados Unidos), y confirmada su etiología en 1884 en la Universidad de Cornell. En 1919 se lo detectó en Nueva Zelanda y a fines de la década de 1950 en Inglaterra. Actualmente está presente en la mayoría de los países productores de frutas de pepita del mundo. Si bien en Argentina aún no se ha detectado esta enfermedad, el riesgo de introducción de la bacteria es muy alto dado que permanentemente se adquiere material vegetal de regiones afectadas por importantes epidemias (Rossini et al., 2013).
.
- Distribucion mundial de E. amylovora. Fuente: Rossini et al., 2013
- Fuente: https://gd.eppo.int/taxon/ERWIAM/distribution
.
.
Síntomas
Los tejidos afectados por los síntomas causados por Erwinia amylovora en frutales de pepita incluyen flores, frutos, brotes y ramas. Todos los síntomas se manifiestan en órganos aéreos (por encima del suelo) y, por lo general, son fáciles de reconocer. Los síntomas en las flores incluyen mancha acuosa o empapada de agua (wáter soaking) del receptáculo floral, el ovario y los pedúnculos. Esto da como resultado un aspecto opaco, gris verdoso, que se manifiesta una a dos semanas después de la caída de los pétalos, y eventualmente los tejidos se marchitan y se vuelven negros. La base de la flor y los frutos jóvenes muestran síntomas similares a los de la infección. Cuando la humedad ambiental es elevada, pueden verse gotitas opacas de exudado bacteriano (zooglea) en el tejido infectado. Los brotes muestran síntomas similares pero se desarrollan mucho más rápidamente. Las hojas enfermas del brote generalmente se ennegrecen a lo largo de la vena media y luego mueren. Cuando el número de brotes enfermos es elevado, le dan al árbol un aspecto de decaimiento muy acentuado. La infección inicial de flores y brotes puede extenderse a las ramas más grandes de los árboles. Las ramas se oscurecen. Una infección avanzada desarrolla grietas en la corteza y en una superficie hundida. La madera debajo de la corteza se raya con una decoloración negra. Las frutas inmaduras forman lesiones con aspecto “empapadas en agua” (wáter soaking) y luego se tornan negras. En estas lesiones se puede encontrar líquido bacteriano. Las infecciones graves causan que la fruta se vuelva completamente negra y se marchite. El inóculo primario de esta enfermedad típicamente se encuentra en los cancros que se formaron la temporada anterior. Los factores que determinan si los chancros se activan o no todavía no son bien conocidos, pero se cree que es más probable que los chancros que se encuentran en las ramas de los árboles más grandes se vuelvan activos. También se piensa que la edad puede ser un factor que influye en este proceso.
.
- 05 Infecciones por Tizón de fuego en manzano: A) flores, B) frutas y C) brotes. La flecha apunta a la exudación bacteriana (zooglea), un signo común de las infecciones bacterianas de E. amylovora, causante del tizón de fuego. Autor:J. Norelli
.
.
- 01 Síntomas del Tizón de fuego en manzano. Autor: I, Paethon.
- 02 Síntomas del Tizón de fuego en peral. Autor: Ninjatacoshell.
- Cancro sobre rama de manzano. Autor: ACIMOVIC S. G., 2018
- 03 Síntomas y Signo del Tizón de fuego en fruto de peral. Autor: M. Bulatovic-Danilovich, APS.
- 04 Síntomas y Signo del Tizón de fuego en fruto de peral.
- Zoogleas de Erwinia sobre manzana. Autor: ACIMOVIC S. G., 2011
.
.
Epidemiología
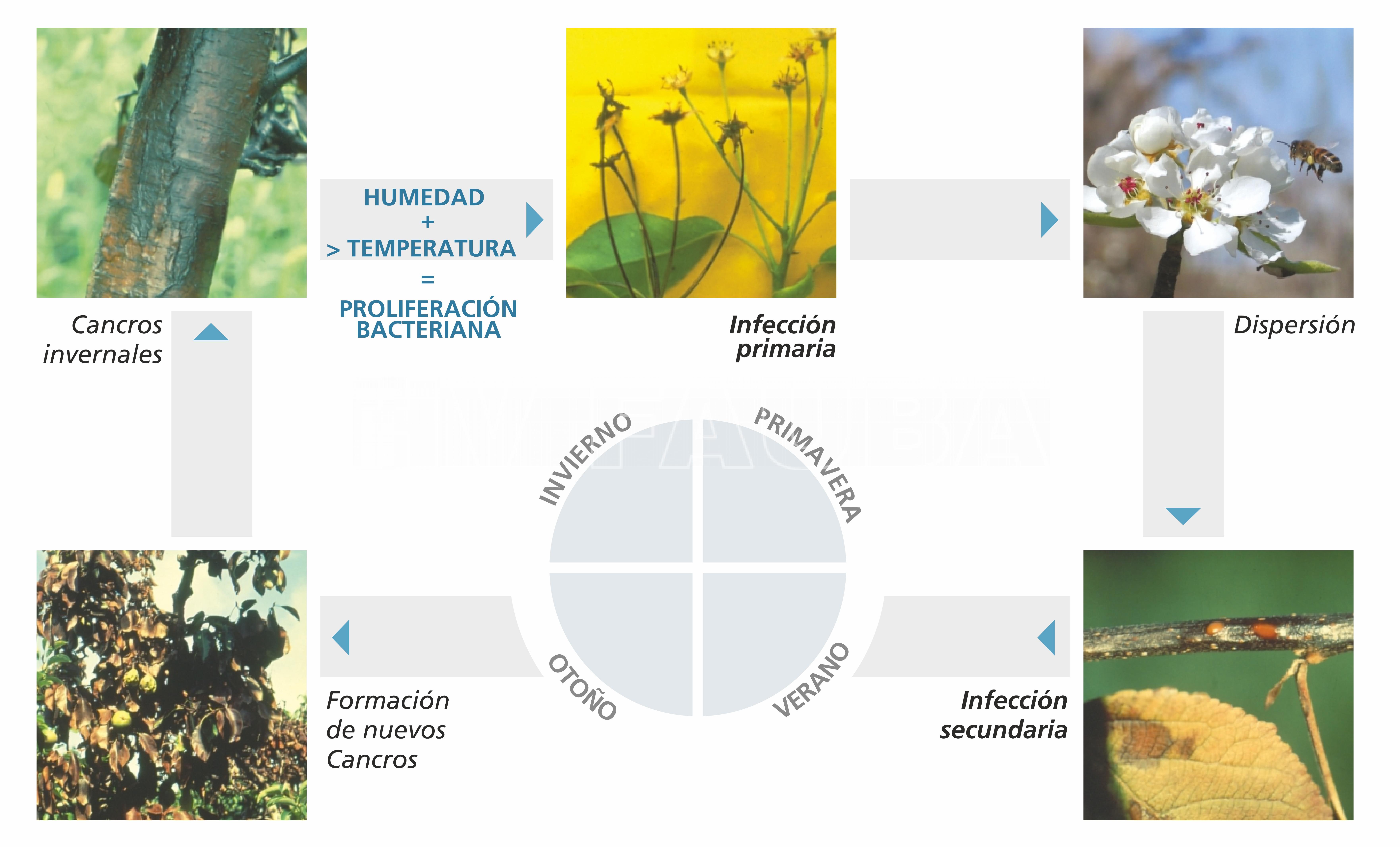
Durante el otoño y el invierno la bacteria disminuye su actividad y se conserva en cancros, frutos momificados, brotes afectados y exudados secos. Durante el invierno, el patógeno sobrevive en los mencionados cancros o ramas infectadas. Al llegar la primavera y coincidentemente con el inicio de la actividad vegetal, la actividad bacteriana se reactiva escurriendo de los tumores o cancros, atrayendo abejas y otros insectos, los cuales diseminan la enfermedad. A continuación, en presencia de condiciones climáticas favorables (lluvias, elevada humedad relativa y temperaturas superiores a los 20ºC), las poblaciones bacterianas se multiplican y comienza el proceso de infección primaria. La lluvia y los agentes dispersantes se encargan de llevar bacterias hacia los órganos vegetales en formación (principalmente flores) e iniciar la infección secundaria, produciendo cancros, exudados y otros síntomas característicos. Los exudados están formados por una gran cantidad de bacterias que generará tantos nuevos ciclos de infección como períodos de condiciones climáticas favorables se produzcan en la temporada agrícola (Rossini et al., 2013).
Las curvas temporales que representan la incidencia de detección de los síntomas causados por E. amylovora en flores de pera en función de la etapa de floración son similares a las curvas de progreso de la enfermedad que se observan comúnmente para las epidemias policíclicas causadas por patógenos foliares (van der Plank 1963). En los procesos policíclicos, la cantidad de inóculo primario es típicamente pequeña, con inóculo secundario adicional producido después de cada monociclo exitoso. Para el Tizón de fuego de las Rosáceas, las células patógenas que surgen de los cancros que hibernan son el inóculo principal (Beer y Opgenorth 1976; Beer y Norelli 1977), y la reproducción epífita del patógeno en superficies florales y la dispersión de flor a flor a través de insectos polinizadores o la lluvia representan los ciclos secundarios (Elkins et al., 2015). En general es una enfermedad policíclica, pero en algunas localidades como en Canadá puede ser monocíclica debido a la corta temporada de crecimiento del cultivo.
.
- Ciclo del Tizón de Fuego de las Rosáceas causado por E. amylovora. Fuente: Rossini et al., 2013
.
Factores abióticos, como lluvia y viento, y factores bióticos, como las abejas y otros insectos, las aves, etc., pueden diseminar la bacteria a los tejidos susceptibles. Los tejidos lesionados (con heridas) también son altamente susceptibles a la infección, incluyendo aquellos que sufrieron pinchazos y desgarros causados por insectos que chupan o muerden las plantas. Las tormentas de granizo pueden provocar heridas que predisponen un monte frutal entero en unos pocos minutos.
Una vez depositada (inoculada), la bacteria ingresa a la planta a través de los estomas abiertos. Al poco tiempo, la enfermedad causa los típicos síntomas (lesiones necróticas ennegrecidas), que también pueden producir un exudado viscoso (signo). Este exudado cargado de bacterias (zooglea) se puede distribuirse a otras partes de la misma planta o hacia áreas susceptibles de diferentes plantas por la acción de dispersión causada por la lluvia y el viento, y aves o insectos, causando infecciones secundarias. La enfermedad se propaga más rápidamente durante el clima cálido y húmedo y permanece inactiva en el invierno cuando las temperaturas disminuyen. Sin embargo, el tejido de la planta infectada contiene bacterias viables y reanudará la producción de exudado cuando regrese el clima cálido en la primavera siguiente. Este exudado es, por lo tanto, la fuente de inóculo primario que causa nuevos ciclos de infecciones primarias en las futuras estaciones de crecimiento.
El patógeno se propaga a través del árbol desde el punto de infección a través del sistema vascular de la planta, hasta llegar a las raíces y/o la unión de injerto de la planta. Una vez que las raíces de la planta se ven afectadas, a menudo se produce la muerte del árbol. La poda excesiva y la fertilización excesiva (especialmente con nitrógeno) pueden producir crecimientos de verano que hacen que el árbol sea más susceptible.
E. amylovora típicamente coloniza en el xilema del hospedante o parénquima cortical. También puede entrar a través de estomas, lentículas e hidatodos. Está dispersado por la lluvia y/o insectos de forma natural, pero este modo de dispersión es muy ineficaz y solo puede ser efectivo para la transmisión local del patógeno. También se sospecha que los aerosoles desempeñan un papel en su transmisión debido a la detección de E. amylovora en las regiones mediterráneas.
.
- Autor: Zachariah Hansen
.
Patogénesis
La patogenicidad depende de muchos factores diferentes, como la producción del sideróforo desferrioxamina, metaloproteasas, plásmidos y proteínas similares a las histonas. Sin embargo, algunos factores esenciales de la patogenicidad son las variaciones en la síntesis de polisacáridos extracelulares (EPS, del ingés: extracellular polysaccharides) y el mecanismo del sistema de secreción tipo III y sus proteínas asociadas (Vrancken et al., 2013; Piqué et al., 2015). Los EPS ayudan a los patógenos bacterianos a evitar las defensas de las plantas, a «obstruir» el sistema vascular del hospedante, a protegerse contra la desecación y a adherirse a ambas superficies y entre sí. Un EPS es amylovoran, un polímero de unidades que repiten el pentasacárido. Si una cepa de E. amylovora no puede producir amylovoran, no es patógena y no se puede propagar en las plantas (Vrancken et al., 2013). Levan es otro EPS, y en aquellas cepas que han perdido su capacidad de síntesis, se retardará el desarrollo de los síntomas. Los sistemas de secreción tipo III se utilizan para exportar y suministrar proteínas efectoras al citosol de las plantas hospedantes. Este sistema consiste principalmente en proteínas Hrc. La motilidad es otro factor importante de virulencia (Vrancken et al., 2013). Dado que E. amylovora no es un biótrofo obligado, puede sobrevivir fuera del hospedante, lo que le permite propagarse de muchas maneras, como la lluvia. La proteína efectora AvrRpt2EA de Erwinia amylovora es importante para el reconocimiento del patógeno en manzanos resistentes al tizón. AvrRpt2EA actúa como un factor de virulencia e induce la formación de ácido salicílico (AS), desencadenando la resistencia sistémica adquirida (SAR) dependiente de AS (Schröpfer et al., 2018).
.
- Autor: Ed Sikora
.
Manejo Integrado de la enfermedad
Si bien la aplicación foliar de antibióticos como estreptomicina o inyectar plantas con oxitetraciclina puede prevenir nuevas infecciones, esta práctica es antieconómica. Además, el uso generalizado de estreptomicina en forma de aerosol ha dado lugar al surgimiento de resistencia a los antibióticos en algunas áreas, como California y Washington, en EE.UU. Ciertos controles biológicos que consisten en aplicar formulaciones de bacterias benéficas o levaduras también pueden evitar que el tizón del fuego infecte árboles nuevos. Sin embargo, el único tratamiento efectivo para las plantas ya infectadas es podar las ramas afectadas y eliminarlas del área de producción. Las plantas o los árboles deben ser inspeccionados rutinariamente para detectar nuevas infecciones. El resto de la planta se puede guardar si se elimina la madera dañada antes de que la infección se extienda a las raíces. No existe una cura conocida, por lo que la prevención es la clave del manejo de esta enfermedad.
E. amylovora necesita ser destruido antes de que ingrese al hospedante. Una vez que penetra en el hospedante, se propaga durante la fase endofítica de la patogénesis, donde los métodos de control externos se vuelven ineficaces. El método de control ideal es aplicar cobre y antibióticos a la planta externamente. Este es el único método efectivo y de hecho es preventivo. Actualmente se ha observado en otros países que E. amylovora ha desarrollado una resistencia al antibiótico estreptomicina, al igual que la mayoría de las bacterias debido a su capacidad flexible para adquirir por transferencia horizontal genes preferenciales que promueven la resistencia a ciertos antibióticos de especies que ni siquiera son similares a ella como todas las bacterias pueden.
- Se recomienda a los países de alto riesgo (como la Argentina) que no importen plantas susceptibles infectadas con el patógeno en su territorio porque, una vez que las bacterias se establecen en un área, es casi imposible erradicar la enfermedad. Los viveros y montes frutales en esas regiones deberían estar sujetos a estrictas medidas de vigilancia fitosanitaria y estár bien controlados. Los cultivos importados e infectados deberían destruirse tan pronto como se detecten, ya que las bacterias se propagan muy rápidamente y los métodos de erradicación suelen ser costosos e ineficientes.
- En otros países xisten variedades resistentes a la enfermedad.
- Se recomienda podar durante la primavera y el verano las ramas infectadas 20 centímetros abajo de donde empieza el daño. Sumergir las herramientas de poda en una solución que contenga 70% de alcohol etílico o 10% de cloro (1 parte de cloro por 9 partes de agua) entre cada corte de poda. Enjuagar y aceitar las tijeras cuando se termine. Estas actividades ayudaran a prevenir la diseminación de la enfermedad.
- Se debe evitar una fertilización excesiva con nitrógeno, especialmente en el verano, un crecimiento desmedido es especialmente susceptible a la infección por la bacteria.
- Evitar salpicar agua en el follaje.
- Si bien el control químico no siempre es efectivo y se necesita aplicar preventivamente, en años calidos y húmedos que coincidan con la floración y la producción de hojas, los árboles se pueden asperjar con sulfato básico de cobre o un antibiótico (ej. agrimicina) para reducir la infección. La aplicaciones con agrimicina se deben realizar cuando inicie la floración, continuando cada 3-4 días durante este periodo. Se debe evaluar si esta práctica es económicamente viable. Es posible que se necesite una re-aplicación cuando haya llovido.
- Con el desarrollo de formulaciones inyectables, la optimización de las dosis y los programas de inyección de inductores de la resistencia (defensas naturales de las plantas) podría servir como una opción eficaz para el control del tizón (Aćimović et al., 2015).
.
Bibliografía
Aćimović SG, Zeng Q, McGhee GC, et al. (2015) Control of fire blight (Erwinia amylovora) on apple trees with trunk-injected plant resistance inducers and antibiotics and assessment of induction of pathogenesis-related protein genes. Frontiers in Plant Science 6: 16. doi: 10.3389/fpls.2015.00016
, , , et al. (2022) Comprehensive prediction of plant cytoplasmic and apoplastic effectors underlying Erwinia psidii pathogenicity. Plant Pathology 00: 1– 14. doi: 10.1111/ppa.13636
Beer SV, Opgenorth DC (1976) Erwinia amylovora on fire blight canker surfaces and blossoms in relation to disease occurrence. Phytopathology 66: 317-322. doi: 10.1094/Phyto-66-317
Beer SV, Norelli JL (1977) Fire Blight Epidemiology: Factors Affecting Release of Erwinia Amylovora by Cankers. Phytopathology 77(9): 1119-125. doi: 10.1094/Phyto-67-1119
Cui Z, Steven B, Zeng Q (2021) Complete Genome Sequences of Curtobacterium, Pantoea, Erwinia, and Two Pseudomonas sp. Strains, Isolated from Apple Flower Stigmas from Connecticut, USA. Microbiol Resour Announc. 10(19): e00154-21. doi: 10.1128/MRA.00154-21
Cui Z, Huntley RB, Schultes NP, et al. (2021) Inoculation of Stigma-Colonizing Microbes to Apple Stigmas Alters Microbiome Structure and Reduces the Occurrence of Fire Blight Disease. Phytobiomes Journal 5: 156-165. doi: 10.1094/PBIOMES-04-20-0035-R
Deng P, Jia J, Foxfire A, et al. (2023) A Polyketide Synthetase Gene Cluster Is Responsible for Antibacterial Activity of Burkholderia contaminans MS14. Phytopathology 113(1): 11-20. doi: 10.1094/PHYTO-03-22-0106-R
Elkins RB, Temple TN, Shaffer CA, et al. (2015) Evaluation of Dormant-Stage Inoculum Sanitation as a Component of a Fire Blight Management Program for Fresh-Market Bartlett Pear. Plant Disease 99(8): 1147-1152. doi: 10.1094/PDIS-10-14-1082-RE
Erfani-Moghadam J, Zarei A (2022) Differential responses of pear cultivars to Erwinia amylovora infection; evidences of involvement the hypersensitivity response in pear resistance to fire blight. Eur J Plant Pathol. doi: 10.1007/s10658-021-02448-9
Esplin IND, et al. (2017) Genome Sequences of 19 Novel Erwinia amylovora Bacteriophages. Genome Announc. 5(46): e00931-17. doi: 10.1128/genomeA.00931-17
Gusberti M, Klemm U, Meier MS, et al. (2015) Fire Blight Control: The Struggle Goes On. A Comparison of Different Fire Blight Control Methods in Switzerland with Respect to Biosafety, Efficacy and Durability. Int J Environ Res Public Health. 12(9): 11422-47. doi: 10.3390/ijerph120911422. PMID: 26378562
Johnson KB, Stockwell VO (1998) Management of fire blight: a case study in microbial ecology. Annual Review of Phytopathology 36: 227-48. doi: 10.1146/annurev.phyto.36.1.227
Johnson KB (2000) Fire Blight of Apple and Pear. The American Phytopathological Society. The Plant Health Instructor. Updated 2015. doi: 10.1094/PHI-I-2000-0726-01
Johnson KB, Temple TN (2013) Evaluation of Strategies for Fire Blight Control in Organic Pome Fruit Without Antibiotics. Plant Disease 97(3): 402-409. doi: 10.1094/PDIS-07-12-0638-RE
Johnson K, Temple TN, Kc A, Elkins RB (2021) Refinement of Non-Antibiotic Spray Programs for Fire Blight Control in Organic Pome Fruit. Plant Disease. doi: 10.1094/PDIS-07-21-1405-RE
Momol MT, Momol EA, Lamboy WF, et al. (1997) Characterization of Erwinia amylovora strains using random amplified polymorphic DNA fragments (RAPDs). Journal of Applied Microbiology 82: 389–398. doi: 10.1046/j.1365-2672.1997.00377.x
Momol MT, Norelli JL, Piccioni DE, et al. (1998) Internal movement of Erwinia amylovora through symptomless apple scion tissues into the rootstock. Plant Disease. 82: 646-650. doi: 10.1094/PDIS.1998.82.6.646
Norelli JL, Jones AL, Aldwinckle HS (2003) Fire management in the twenty-first century, using new technologies that enhance host resistance in apple. Plant Disease 87: 756-765. doi: 10.1094/PDIS.2003.87.7.756
Norelli JL (2004) Fire Bligth. Pp: 443-447. En: Goodman RM (ed). Encyclopedia of Plant and Crop Science. Marcel Dekker, Inc. NY., USA. 1329p.
Ordax Ibáñez M (2008) Supervivencia de Erwinia amylovora en condiciones de estrés: influencia de la presencia de cobre y la limitación de nutrientes. Tesi doctoral, Instituto Valenciano de Investigaciones Agrarias y Universidad de Valencia. Link
Palacio-Bielsa A, Cambra Álvarez MA. El fuego bacteriano de las rosáceas (Erwinia amylovora). Ministerio de Medio Ambiente y Medio Rural y Marino. 97 p. ISBN: 978-84-491-0962-1. Link
Pedroncelli A, Puopolo G (2023) This tree is on fire: a review on the ecology of Erwinia amylovora, the causal agent of fire blight disease. J Plant Pathol. doi: 10.1007/s42161-023-01397-y
, , Orchestration of virulence factor expression and modulation of biofilm dispersal in Erwinia amylovora through activation of the Hfq‐dependent small RNA RprA. Molecular Plant Pathology 22: 255– 270. doi: 10.1111/mpp.13024
Piqué N, Miñana-Galbis D, Merino S, Tomás J (2015) Virulence Factors of Erwinia Amylovora: A Review. International Journal of Molecular Sciences 16.6: 12836-2854. doi: 10.3390/ijms160612836
Romo Chacón A, Berlanga Reyes DI, Guerrero Prieto VM, et al. (2011) Manejo de Erwinia amylovora con Aceite Esencial de Orégano (Lippia berlandieri) y Estudio de Resistencia a Estreptomicina en Arboles de Manzano cv. ‘Golden Delicious’. Revista mexicana de fitopatología, 29(2): 119-132. Link
Rossini et al. (2013) Detección precoz de Tizón de Fuego. INTA Centro Regional Patagonia Norte, EEA Alto Valle. 12 p. Link
Sampietro DA, Bertini Sampietro MS, Vattuone MA (2020) Efficacy of Argentinean propolis extracts on control of potato soft rot caused by Erwinia carotovora subsp. J. Sci. Food Agric. 100: 4575-4582. doi: 10.1002/jsfa.10516
Schröpfer S, Böttcher C, Wöhner T, et al. (2018) A Single Effector Protein, AvrRpt2EA, from Erwinia amylovora Can Cause Fire Blight Disease Symptoms and Induces a Salicylic Acid-Dependent Defense Response. Molecular Plant Microbe Interactions 31(11): 1179–1191. doi: 10.1094/MPMI-12-17-0300-R
Schroth MN, Thomson SV, Hildebrand DC, Moller WJ (1974) Epidemiology and Control of Fire Blight. Annual Review of Phytopathology 12: 389-412. doi: 10.1146/annurev.py.12.090174.002133
Sharma R, et al. (2018) Genome Sequences of Nine Erwinia amylovora Bacteriophages. Microbiol Resour Announc. 7(14): e00944-18. doi: 10.1128/MRA.00944-18
Sobiczewski P, Iakimova ET, Mikiciński A, et al. (2017) Necrotrophic behaviour of Erwinia amylovora in apple and tobacco leaf tissue. Plant Pathology 66: 842-855. doi: 10.1111/ppa.12631
(1963) Plant diseases: epidemics and control. Academic Press, New York, NY., 349 pp.
Vrancken K, Holtappels M, Schoofs H, et al. (2013) Pathogenicity and infection strategies of the fire blight pathogen Erwinia amylovora in Rosaceae: State of the art. Microbiology 159(5): 823-832. doi: 10.1099/mic.0.064881-0
Yuan X, McGhee GC, Slack SM, Sundin GW (2021) A Novel Signaling Pathway Connects Thiamine Biosynthesis, Bacterial Respiration, and Production of the Exopolysaccharide Amylovoran in Erwinia amylovora. Mol Plant Microbe Interact. MPMI04210095R. doi: 10.1094/MPMI-04-21-0095-R
Yuan X, Sundin GW, Zeng Q, et al. (2023) Erwinia amylovora Type III Secretion System Inhibitors Reduce Fire Blight Infection Under Field Conditions. Phytopathology 113(12): 2197-2204. doi: 10.1094/PHYTO-04-23-0111-SA
Zeng Q, Slack S, Amine Hassani M (2023) Pathogen Spotlight on Erwinia amylovora-Recent Advances in Genomics, Resistance Breeding, and Disease Management. Phytopathology 113(12): 2140-2142. doi: 10.1094/PHYTO-11-23-0439-SA