.
Condición fitosanitaria: Presente
Grupo de cultivos: Hortícolas
Especie hospedante: frutilla, fresa (español), fragola (italiano), morango (portugués), fraise (francés), strawberry (inglés), terdbeere (alemán), (Fragaria × ananassa (Weston) Duchesne)
Rango de hospedantes: no específico / Amplio. Muchas frutas y verduras son susceptibles a este patógeno. Algunos géneros susceptibles incluyen:
Allium, Ananas, Brassica, Cucumis, Cucurbita, Fragaria, Lycopersicon, Phaseolus, Solanum y varios más.
Etiología: Hongo. Necrotrófico
Agente causal: Rhizopus stolonifer Ehrenb. (Ex Fr.) Lind
Taxonomía: Fungi > Phylum Zygomycota > Fungi incertae sedis >
Mucoromycota > Mucoromycotina > Mucoromycetes > Mucorales > Mucorineae > Rhizopodaceae > Rhizopus
.
.
.
.
Síntomas
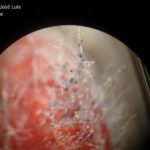
La fruta infectada se vuelve muy blanda y empieza a gotear un líquido rojo que sale de los tejidos descompuestos (ablandamiento del fruto y exudado). En estadios avanzados de infección la fruta prácticamente se encuentra disuelta. La fruta afectada normalmente es cubierta por filamentos blancos y negros del patógeno. Las estructuras de reproducción asexual, los esporangios (signo), que contienen en su interior las esporangiosporas, pueden distinguirse con una lupa, ubicándose en el extremo de las hifas filamentosas.
.
- Autor: Ed Sikora
.
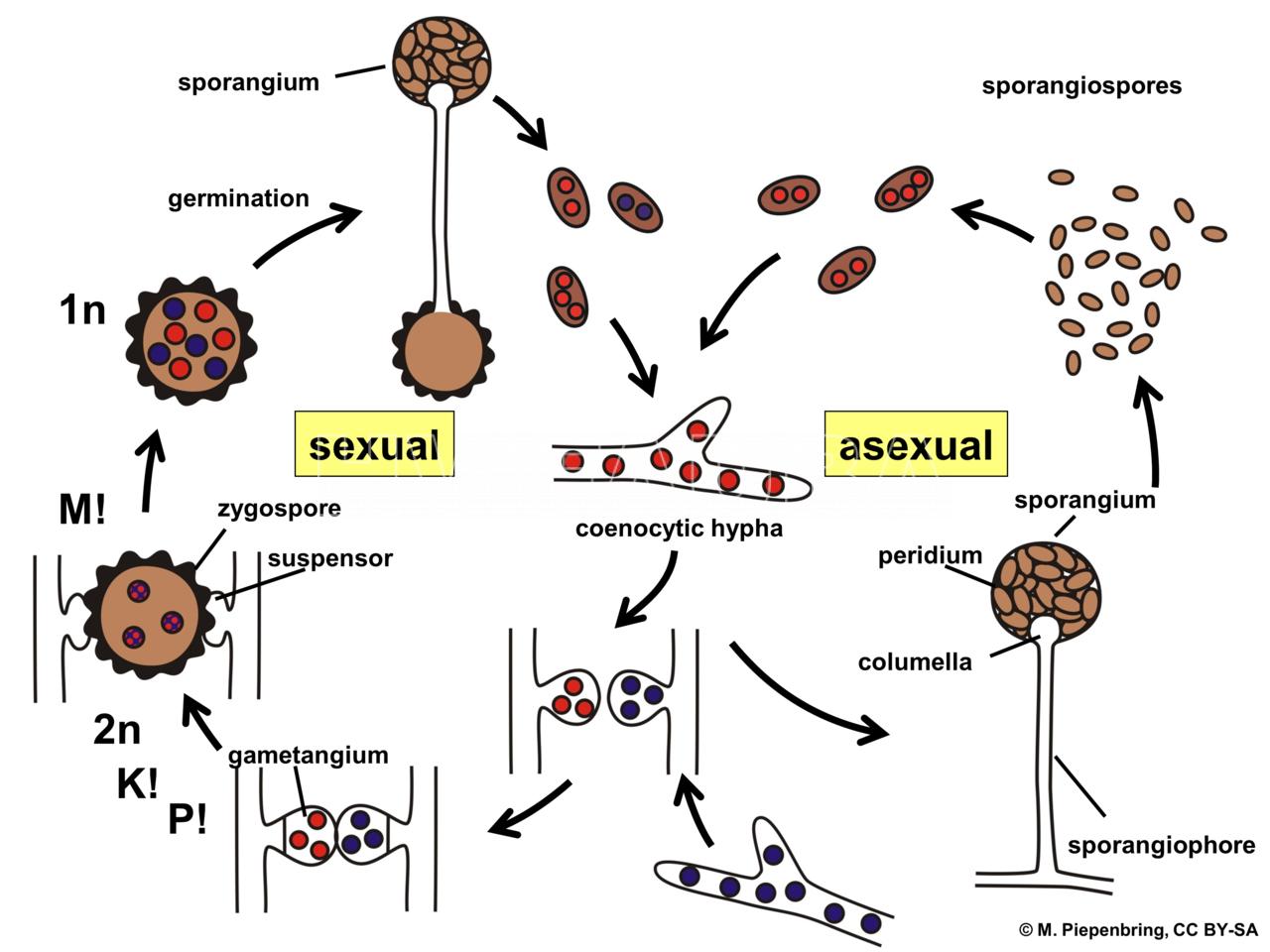
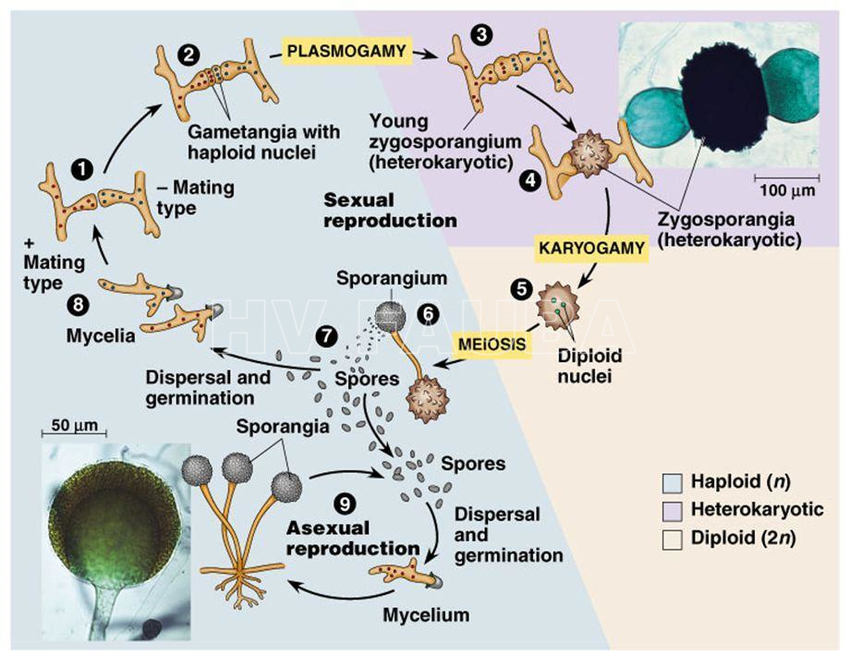
Este patógeno presenta micelio cenocítico (no septado), pero que puede formar septos ocasionalmente cuando envejece, y en la base de estructuras reproductivas. Algunas especies, cuando entran en contacto con superficies duras, forman rizoides, prolongaciones hifales con aspecto de raíces. Los rizoides se adhieren al sustrato. La hifa que conecta dos grupos de rizoides se denomina estolón. Los esporangios están ubicados sobre esporangióforos los cuales suelen emerger en fascículos a partir de un mismo tramo de la hifa. En ese punto suelen formarse rizoides que fijan el micelio al sustrato y mantienen erguidas a las fructificaciones. En los esporangios se distingue una zona esporífera, en la que se forman las esporangiosporas, y la columela que queda separada de la anterior por una pared y está unida en su base al esporangióforo.
La espora sexual es la zigospora formada por conjugación gametangial entre gametangios morfológicamente iguales o similares, plurinucleados, generalmente pertenecientes a talos diferentes compatibles. No se les asigna sexo masculino y femenino, sino que se designan con los signos + y -. Cuando dos hifas compatibles están próximas se producen estímulos químicos que promueven la formación de progametangios, prolongaciones de ambas hifas que se ensanchan y tienden a acercarse hasta ponerse en contacto. Posteriormente se forma un septo que delimita el gametangio y la célula basal suspensora en cada una de las hifas. Se disuelven las paredes que separan ambos gametangios y se produce la plasmogamia por conjugación de los contenidos de ambos gametangios. La célula formada se denomina inicialmente prozigospora, aumenta de tamaño y desarrolla una pared gruesa y rugosa (que le otorga resistencia), transformándose en una zigospora Dentro de ésta ocurren los procesos de cariogamia y meiosis, y, cuando germina, da origen a un esporangio con esporangiosporas recombinantes a partir de las hifas que originaron la zigospora.
Rhizopus es fácil de distinguir del moho gris causado por Botrytis, ya que infecciones de Botrytis no ablandecen la fruta, ni producen goteo de líquidos, y el crecimiento de Botrytis es de color gris a marrón. Asimismo, Rhizopus presenta, al contrario de Mucor, una orientación de esporangios sin ningún arreglo y al azar. Además, los esporangios parecen secos, mientras en el caso de Mucor, los esporangios parecen mojados y pegajosos por tener un líquido viscoso.
.
.
- 1 Rhizopus stolonifer
- 2 Rhizopus stolonifer
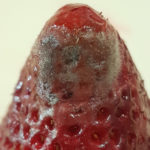
Daños
R. stolonifer es considerado uno de los principales fitopatógenos que provocan enfermedades postcosecha (Baggio et al., 2016). Es el agente causal de la pudrición blanda de frutas y hortalizas, ocasionando importantes pérdidas económicas. Se encuentra ampliamente distribuido en la naturaleza sobreviviendo de manera saprófita en el suelo y en residuos orgánicos con el potencial de invadir tejidos vegetales. El hongo puede penetrar directamente la cutícula de frutos no heridos, probablemente debido a la producción de las enzimas esterasas (Baggio et al., 2016).
.
- Signo de la enfermedad (esporangios sobre esporangióforos)
.
Epidemiología y condiciones predisponentes
La mayoría de los Mucorales son saprófitos, y muchos de ellos desarrollan sobre alimentos causando su deterioro. Las esporas de R. stolonifer pueden sobrevivir largos períodos sin agua y soportar temperaturas elevadas, germinando sobre tejidos vegetales dañados y generando rápidamente la maceración de los tejidos y la pudrición de los frutos. R. stolonifer puede sobrevivir durante meses en los suelos, sus esporas se diseminan en el aire y al encontrar las condiciones favorables germinan y se desarrollan. Los frutos maduros y dañados son más susceptibles a la infección. Se ha observado una alta correlación entre el número de esporas y la incidencia de la enfermedad.
Generalmente, las heridas son causadas durante la cosecha y el transporte de los productos hortofrutícolas, por consiguiente, las mayores pérdidas por pudriciones causadas por R. stolonifer se presentan después de la cosecha y durante el empaque. R. stolonifer posee una rápida velocidad de crecimiento y se desarrolla en una amplia variedad de temperaturas y humedades relativas, características que le permiten colonizar rápidamente al hospedante. Una vez que se inicia la lesión, este hongo fitopatógeno puede invadir el resto del fruto y los adyacentes, creando redes sobre las frutillas, que en pocos días pueden llegar a afectar la totalidad de las mismas. En solamente cuatro días puede pudrir totalmente los frutos, provocando pérdidas considerables en un corto período de tiempo (Northover y Zhou, 2002).
- Esquema del ciclo vital de Rhizopus stolonifer.
- Esquema del ciclo de vida de Rhizopus stolonifer. Fuente: Vazhacharickal et al. 2015.
.
Manejo de la enfermedad
* Eliminar fruta vieja y podrida de las plantas.
* Manipular fruta de manera de no dañarla o herirla, para prevenir la infección al evitar heridas por donde puedan penetrar.
* Enfriar la fruta en forma inmediata a la cosecha. Esta práctica de manejo ayuda bastante a la prevención del aumento de pudrición por Rhizopus, ya que este hongo no es muy activo por debajo de los 4,4 grados Celsius. Al no crecer a temperaturas inferiores a 5 °C, el buen manejo de la temperatura es el método más simple de control.
* Control biológico: utilizar productos vegetales, antagonistas microbianos y quitosano, solas o combinadas entre sí para potenciar su efecto (El Ghaouth et al., 1992; Bautista-Baños et al., 2006; Velázquez-del Valle et al., 2008)
* Aplicación de fungicidas ( Velázquez-del Valle et al., 2008)
* El uso de atmósfera controlada (AC) o atmósfera modificada (AM) debe ser considerado como un complemento a los adecuados procedimientos de manejo de la temperatura y humedad relativa. En ambas implementaciones el principal efecto sobre la fisiología de la fruta es la disminución del metabolismo y por lo tanto el control del hongo.
.
.
.
.
Bibliografía
Baggio JS, Gonçalves FP, Lourenço SA, et al. (2016) Direct penetration of Rhizopus stolonifer into stone fruits causing rhizopus rot. Plant Pathology 65: 633-642. doi: 10.1111/ppa.12434
Bautista-Baños S, Hernández-Lauzardo AN, Velázquez-del Valle MG, et al. (2006) Chitosan as a potential natural compound to control pre and postharvest diseases of horticultural commodities. Crop Protection 25:108-118.
El Ghaouth A, Arul J, Grenier J, Asselin A (1992) Antifungal activity of chitosan on two postharvest pathogens of strawberry fruits. Phytopathology 82: 398-402.
Montaño DE, Voigt K (2020) Host Immune Defense upon Fungal Infections with Mucorales: Pathogen-Immune Cell Interactions as Drivers of Inflammatory Responses. Journal of Fungi 6(3): 173. doi: 10.3390/jof6030173
Northover J, Zhou T (2002) Control of Rhizopus rot of peaches with postharvest treatments of tebuconazole, fludioxonil, and Pseudomonas syringae. Canadian Journal of Plant Pathology 24:144-153.
Santacruz S, Cedeño J (2021) Alkaline solution as a control of Botrytis cinerea, Rhizopus stolonifer, Salmonella spp. and Escherichia coli growth in strawberry (Fragaria x ananassa). Revista Facultad Nacional de Agronomía Medellín 74: 9615-9619. doi: 10.15446/rfnam.v74n2.90319
Vazhacharickal PJ et al. (2015) Effect of concentration and ph on the preservative action of calcium propionate against black bread mold (Rhizopus stolonifer) in Kerala. CIBTech Journal of Biotechnology 4 (2): 1-12.
Velázquez-del Valle MG, Bautista-Baños S, Hernández Lauzardo AN, et al. (2008) Estrategias de Control de Rhizopus stolonifer Ehrenb. (Ex Fr.) Lind, Agente Causal de Pudriciones Postcosecha en Productos Agrícolas. Revista Mexicana de Fitopatología 26:49-55.
Ventura-Aguilar RI, Díaz-Galindo EP, Bautista-Baños S, et al. (2021) Monitoring the infection process of Rhizopus stolonifer on strawberry fruit during storage using films based on chitosan/polyvinyl alcohol/polyvinylpyrrolidone and plant extracts. Int J Biol Macromol. 182: 583-594. doi: 10.1016/j.ijbiomac.2021.03.187
Wang Y, Chang Y, Ortañez J, et al. (2023) Divergent evolution of early terrestrial fungi reveals the evolution of Mucormycosis pathogenicity factors. Genome Biol Evol.: evad046. doi: 10.1093/gbe/evad046
Xu X, Agyare S, Browne E, Passey T (2024) Predicting infection of strawberry fruit by Mucor and Rhizopus spp. under protected conditions. Front. Hortic. 3: 1373717. doi: 10.3389/fhort.2024.1373717