.
Condición fitosanitaria: Presente
Grupo de cultivos: Hortícola
Especie hospedante: Cebolla (Allium cepa)
Rango de hospedantes: no específico / amplio
Epidemiología: policíclica, subaguda
Etiología: Hongo. Necrotrófico
Agente causal: Botrytis spp, B. allii, B. aclada,
Taxonomía: Fungi > Dikarya > Ascomycota > saccharomyceta > Pezizomycotina > leotiomyceta > sordariomyceta > Leotiomycetes > Helotiales > Sclerotiniaceae > Botrytis
En E.E.U.U., 7 especies de Botrytis se han asociado con enfermedades de los cultivos cebolla. Especificamente las especies B. allii, B. aclada, B. porri, B. squamosa y B. tulipae fueron asociadas con la Podredumbre del cuello de la cebolla (Chilvers and du Toit, 2006).
.
- Cuerpos de fructificación sexual (apotecio), a partir de estructura de resistencia (esclerocio), del teleomorfo Botryotinia fuckeliana. Autor: Dean et al., 2012.
.
.
Importancia económica
Esta enfermedad representa la principal enfermedad de postcosecha en climas frescos (Delhey et al., 2015).
.
Sintomatología
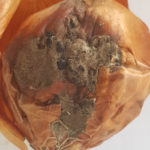
Se observa una podredumbre generalizada que, a diferencia de la podredumbre bacteriana, no respeta las catáfilas individuales. Al principio se observa un aspecto acuoso, que luego oscurece y ablanda los tejidos foliares. Puede observarse el típico moho gris y finalmente los esclerocios negros y grandes. A medida que la enfermedad avanza todo el bulbo se pudre y momifica.
.
- Autor: Ida Wilson
- Autor: Ida Wilson
- Autor: Ida Wilson
.
Ciclo de la enfermedad
En general el moho gris (Botryotinia fuckeliana / Botrytis cinerea) se considera un patógeno débil, que solo infecta las plantas dañadas o débiles. El inóculo primario está constituido por semillas infestadas y esclerocios libres en el suelo o en restos del cultivo anterior de cebolla. La semilla de cebolla producida en Cuyo se encuentra libre de Botrytis por el momento. El hongo produce infecciones latentes del cuello que no muestran síntomas y que lentamente avanzan durante el almacenamiento de las cebollas luego de la cosecha.
.
Esquema del ciclo de vida del patógeno
.
Manejo
Rotaciones con otros cultivos.
Curado de cuello.
Evitar uso tardío de fertilizante nitrogenado.
Aplicar fungicida sistémico a la semillas en lotes destinados a producción de semilla.
.
Bibliografía
Amselem J, Cuomo CA, van Kan JAL, et al. (2011) Genomic analysis of the necrotrophic fungal pathogens Sclerotinia sclerotiorum and Botrytis cinerea. PLoS Genetics 7, e1002230. doi: 10.1371/journal.pgen.1002230
Bi K, Scalschi L, Jaiswal N, et al. (2021) The Botrytis cinerea Crh1 transglycosylase is a cytoplasmic effector triggering plant cell death and defense response. Nature Communications 12: 2166. doi: 10.1038/s41467-021-22436-1
Bolton MD, Thomma BPHJ, Nelson BD (2006) Sclerotinia sclerotiorum (Lib.) de Bary: biology and molecular traits of a cosmopolitan pathogen. Molecular Plant Pathology 7: 1-16. doi: 10.1111/j.1364-3703.2005.00316.x
Cheung N, Tian L, Liu X, Li X (2020) The Destructive Fungal Pathogen Botrytis cinerea—Insights from Genes Studied with Mutant Analysis. Pathogens 9(11): 923. doi: 10.3390/pathogens9110923
Chilvers MI, du Toit LJ (2006) Detection and Identification of Botrytis Species Associated with Neck Rot, Scape Blight, and Umbel Blight of Onion. Online. Plant Health Progress doi: 10.1094/PHP-2006-1127-01-DG
Dean et al. (2012) The Top 10 fungal pathogens in molecular plant pathology. Molecular Plant Pathology 13: 414-430. doi: 10.1111/j.1364-3703.2011.00783.x
Delhey R., Kiehr M, Azpilicueta A, Frayssinet S (2015) Diagnóstico y Manejo de Enfermedades de Cebolla. Guía de Campo para productores y profesionales. 1ra Ed. ISBN 978-987-33-8827-9
Fillinger S, Elad Y (2016) Botrytis – the Fungus, the Pathogen and its Management in Agricultural Systems. Springer International Publishing Switzerland. doi: 10.1007/978-3-319-23371-0
Garfinkel AR (2021) The History of Botrytis Taxonomy, the Rise of Phylogenetics, and Implications for Species Recognition. Phytopathology 111(3): 437-454. doi: 10.1094/PHYTO-06-20-0211-IA
Izquierdo-Bueno I, González-Rodríguez VE, Simon A, et al. (2018) Biosynthesis of abscisic acid in fungi: identification of a sesquiterpene cyclase as the key enzyme in Botrytis cinerea. Environ Microbiol. 20(7): 2469-2482. doi: 10.1111/1462-2920.14258
Jiang M, Xu X, Song J, et al. (2021) Streptomyces botrytidirepellens sp. nov., a novel actinomycete with antifungal activity against Botrytis cinerea. Int J Syst Evol Microbiol. 71(9). doi:
Kritzman G (1983) Identification of latent Botrytis allii Munn in onion bulbs. Crop Protection 2: 243-246. https://doi.org/10.1016/0261-2194(83)90051-0
Kuroyanagi T, Bulasag AS, Fukushima K, et al. (2022) Botrytis cinerea identifies host plants via the recognition of antifungal capsidiol to induce expression of a specific detoxification gene. PNAS Nexus 1(5): pgac274. doi: 10.1093/pnasnexus/pgac274
Leisen T, Werner J, Pattar P, et al. (2022) Multiple knockout mutants reveal a high redundancy of phytotoxic compounds contributing to necrotrophic pathogenesis of Botrytis cinerea. PLoS Pathog 18(3): e1010367. doi: 10.1371/journal.ppat.1010367
Li X, Gao X, Hu S, et al. (2022) Resistance to pydiflumetofen in Botrytis cinerea: risk assessment and detection of point mutations in sdh genes that confer resistance. Pest Manag Sci 78: 1448-1456. doi: 10.1002/ps.6762
Liu Y, Liu JK, Li GH, et al. (2019) A novel Botrytis cinerea-specific gene BcHBF1 enhances virulence of the grey mould fungus via promoting host penetration and invasive hyphal development. Molecular Plant Pathology 20(5): 731-747. doi: 10.1111/mpp.12788
Liu K, Wen Z, Ma Z, et al. (2022) Biological and molecular characterizations of fluxapyroxad-resistant isolates of Botrytis cinerea. Phytopathol Res 4: 2. doi: 10.1186/s42483-022-00107-3
Malandrakis AA, Krasagakis N, Kavroulakis N (2022) Fungicide resistance frequencies of Botrytis cinerea greenhouse isolates and molecular detection of a novel SDHI resistance mutation. Pesticide Biochemistry and Physiology: 105058. doi: 10.1016/j.pestbp.2022.105058
Oren-Young L, Llorens E, Bi K, Zhang M, Sharon A (2021) Botrytis cinerea methyl isocitrate lyase mediates oxidative stress tolerance and programmed cell death by modulating cellular succinate levels. Fungal Genetics and Biology 146: 103484. https://doi.org/10.1016/j.fgb.2020.103484
(1979) Sclerotinia sclerotiorum: history, diseases and symptomatology, host range, geographic distribution, and impact. Phytopathology 69: 875–880. doi: 10.1094/Phyto-69-875
Richards JK, Xiao CL, Jurick WM 2nd (2021) Botrytis spp.: A Contemporary Perspective and Synthesis of Recent Scientific Developments of a Widespread Genus that Threatens Global Food Security. Phytopathology 111(3): 432-436. doi: 10.1094/PHYTO-10-20-0475-IA
Roca-Couso R, Flores-Félix JD, Rivas R (2021) Mechanisms of Action of Microbial Biocontrol Agents against Botrytis cinerea. Journal of Fungi. 7(12): 1045. doi: 10.3390/jof7121045
Valero-Jiménez CA, Steentjes MBF, Slot JC, Shi-Kunne X, Scholten OE, van Kan JAL (2020) Dynamics in Secondary Metabolite Gene Clusters in Otherwise Highly Syntenic and Stable Genomes in the Fungal Genus Botrytis. Genome Biology and Evolution 12(12): 2491-2507. doi: 10.1093/gbe/evaa218
Vik J., Aastveit K. (1984) Breeding for resistance to neck rot (Botrytis allii) in onions (Allium cepa). Euphytica 33: 257. https://doi.org/10.1007/BF00022774