.
Condición fitosanitaria: Presente
Grupo de cultivos: Legumbres
Especie hospedante: Maní (Arachis hypogaea)
Etiología: Hongo. Necrotrófico
Agente causal:
Viruela temprana: Cercospora arachidicola (anamorfo), Mycosphaerella arachidis Deighton, 1967 (teleomorfo)
Viruela tardía: Nothopassalora personata (Berk. & M.A. Curtis) U. Braun, C. Nakash., Videira & Crous, 2017, syn Cercosporidium personatum
.
Taxonomía:
Cercospora arachidicola
Fungi > Dikarya > Ascomycota > saccharomyceta > Pezizomycotina > leotiomyceta > dothideomyceta > Dothideomycetes > Dothideomycetidae > Capnodiales > Mycosphaerellaceae > Mycosphaerella
.
Cercosporidium personatum
Fungi > Dikarya > Ascomycota > saccharomyceta > Pezizomycotina > leotiomyceta > dothideomyceta > Dothideomycetes > Dothideomycetidae > Capnodiales > Mycosphaerellaceae > Nothopassalora > Nothopassalora
.
Ambas especies están presentes según diferentes áreas, lotes y campañas agrícolas (Marinelli y March, 2005a), pero en las últimas campañas ha prevalecido C. personatum (Oddino et al., 2007; 2008b; 2009a).
.
Agente etiológico
* Viruela temprana: Cercospora arachidicola
* Viruela tardía: Nothopassalora personata, syn Cercosporidium personatum
La viruela es una de las enfermedades más destructivas del maní (Arachis hypogaea L.) en todo el mundo y se encuentra ampliamente distribuida. En Argentina, la viruela temprana fue predominante hasta comienzos de la década de 1980 (Giorda et al., 1984). Desde entonces una u otra especie se alternaron en predominancia según áreas, lotes y campaña agrícola (Marinelli y March, 2005a), pero en las últimas campañas agrícolas ha prevalecido N. personata (Oddino et al., 2007; 2008; 2009a).
.
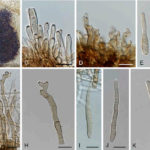
- A ‒ E. Observaciones in vivo. A, B. Síntomas de manchas foliares en el hospedante. C, D. Conidióforos y células conidiógenas. E. Conidias individuales. F – K. Observaciones in vitro. F. Cultura en el SCN. G. Conidióforo y células conidiógenas. H. Conidióforo parcial y células conidiógenas. I ‒ K. Conidios individuales. Barras de escala = 10 μm. Autor: Videira et al. 2017
- Características morfológicas de Nothopassalora personata. (a – c) conidióforos fasciculados, (d – h) conidios. Barras de escala = 10 μm. Autor: Bakhshi y Zare, 2020.
- Fuente: www.infectario.ufv.br
.
.
Importancia económica
La Viruela es la principal enfermedad foliar del cultivo del maní en todas las áreas productoras de maní del mundo (Culbreath et al., 2002). En Argentina, la enfermedad es endémica en la provincia de Córdoba, y se presenta todos los años, en la mayoría de los ciclos agrícolas, con elevada intensidad. A modo de ejemplo, los datos disponibles con los que se cuenta actualmente indican que en la campaña agrícola 2005/2006 se estimaron pérdidas causadas por Viruela por 35 millones de dólares, aun cuando los lotes fueron tratados con fungicidas (March et al., 2011).
.
Sintomatología
En la etapa inicial del desarrollo de los síntomas se observan manchas pequeñas en los folíolos. Posteriormente, a medida que la enfermedad progresa, las manchas adquieren mayor tamaño, siendo irregularmente circulares, de 2 – 7 mm de diámetro y color marrón claro a oscuro frecuentemente con un halo amarillento. La presencia o intensidad del halo clorótico en la superficie superior de la hoja no siempre es una característica confiable para distinguir entre viruela temprana y tardía. En la cara abaxial o inferior de los folíolos las manchas causadas por C. arachidicola tienen coloración marrón clara (canela) y aspecto liso, de textura suave (sin esporulación), mientras que las manchas por N. personata son típicamente de color marrón oscuro a casi negro y pueden ser de textura áspera cuando se producen esporas (aspecto rugoso). Sin embargo, es muy difícil diferenciar a campo ambas viruelas basándose en los síntomas, ya que el color de las manchas no es una característica identificativa. Para confirmar la identidad es necesario observar la esporulación del/los hongo/s sobre las manchas (signo de la enfermedad) (March y Marinelli, 2005). Bajo condiciones de elevada humedad ambiente (períodos lluviosos), es posible observar la esporulación con la ayuda de una lupa de mano de muy buena definición. Los conidios y conidióforos de C. arachidicola son blanquecinos y se observan principalmente sobre la cara superior de las manchas, mientras que las de N. personata son de color marrón oscuro a negro y se producen sobre la cara inferior de los folíolos. Si bien ambas especies pueden presentarse simultáneamente en un mismo lote, causando manchas en los mismos folíolos, incluso de manera superpuesta, lo que dificulta el diagnóstico, en los últimos años en Argentina ha predominado N. personata como agente causal de viruela.
La defoliación y el desprendimiento de cajas (vainas) sanas durante la cosecha por el debilitamiento de los ginóforos causadas por la viruela son la principal causa de disminución de rendimiento (daños) causados por la enfermedad (Singh et al., 2011).
.
- Síntomas de viruela del maní causados por Nothopassalora personata en (A) la superficie superior y (B) inferior de la hoja de maní; (C) características morfológicas de Nothopassalora personata en medios SNA, (D) Stromata in vitro en medios POA, (E) Conidios in vitro, (F) Conidios in vivo. Observaciones in vivo de Nothopassalora personata: (G) síntomas en el signo (estromas) en el hospedante, (H-I) conidióforos y conidios, (J) Conidios individuales. Barras de escala 10 μm. Autor: Monguillot et al., 2023
.
.
- 01. a) Síntomas de viruela tardía en cultivo de maní en Argentina, b) manchas en cara superior; c) esporulación de N. personata en cara inferior. Fuente: Fernandez y Giayetto, 2017.
- 02 Síntomas de viruela tardía causada por Nothopassalora personata, syn Cercosporidium personatum. Autor: John P. Damicone
- 03 Síntomas de viruela tardía causada por Nothopassalora personata, syn Cercosporidium personatum en el envés de los folíolos. Las manchas son típicamente de color marrón oscuro a casi negro y pueden ser de textura áspera cuando se producen esporas (aspecto rugoso). Autor: Austin Hagan, Auburn University.
- 04 Síntomas de viruela temprana causada por C. arachidicola. Fuente: University of Tennessee.
- 05 Síntomas de viruela temprana causada por C. arachidicola. Fuente: Autor: John P. Damicone.
- 06 Síntomas de viruela temprana causada por C. arachidicola en el envés de los folíolos. Las manchas son de textura suave (sin esporulación) y de color marrón. Autor: John P. Damicone.
- 07 Síntomas de viruela temprana causada por C. arachidicola en el envés de los folíolos. Las manchas son de textura suave (sin esporulación) y de color marrón. Autor: John P. Damicone.
- Fuente: www.infectario.ufv.br
- 08 Conidios de Cercospora arachidicola
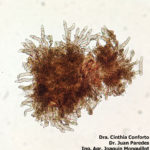
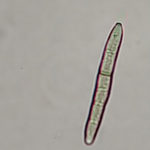
- 01 Manchas de Viruela del mani causadas por Nothopassalora personata. Autores: Dra. Cinthia Conforto; Dr. Juan Paredes; Ing. Agr. Joaquin Monguillot
- 02 Manchas de Viruela del mani causadas por Nothopassalora personata sobre el enves de folíolo. Autores: Dra. Cinthia Conforto; Dr. Juan Paredes; Ing. Agr. Joaquin Monguillot
- 03 Detalle de mancha de Viruela del mani causadas por Nothopassalora personata. Autores: Dra. Cinthia Conforto; Dr. Juan Paredes; Ing. Agr. Joaquin Monguillot
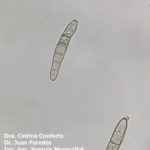
- 04 Conidióforos de Nothopassalora personata. Autores: Dra. Cinthia Conforto; Dr. Juan Paredes; Ing. Agr. Joaquin Monguillot
- 05 Conidióforos de Nothopassalora personata. Autores: Dra. Cinthia Conforto; Dr. Juan Paredes; Ing. Agr. Joaquin Monguillot
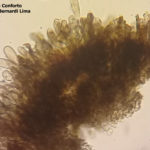
- 06 Conidio de Nothopassalora personata. Autores: Dra. Cinthia Conforto; Dr. Juan Paredes; Ing. Agr. Joaquin Monguillot
- 07 Conidio de Nothopassalora personata. Autores: Dra. Cinthia Conforto; Dr. Juan Paredes; Ing. Agr. Joaquin Monguillot
- 08 Conidio de Nothopassalora personata. Autores: Dra. Cinthia Conforto; Dr. Juan Paredes; Ing. Agr. Joaquin Monguillot
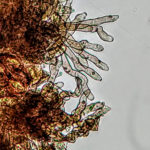
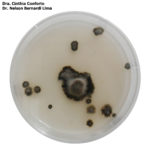
- 01 Conidios y conidióforos de Nothopassalora personata. Autores: Dra. Cinthia Conforto y Dr. Nelson Bernardi Lima.
- 02 Conidios y conidióforos de Nothopassalora personata. Autores: Dra. Cinthia Conforto y Dr. Nelson Bernardi Lima.
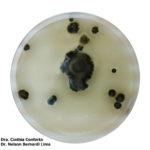
- 03 Colonias de Nothopassalora personata creciendo en POA. Autores: Dra. Cinthia Conforto y Dr. Nelson Bernardi Lima.
- 04 Colonias de Nothopassalora personata creciendo en POA. Autores: Dra. Cinthia Conforto y Dr. Nelson Bernardi Lima.
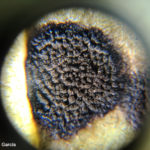
- 01 Autor: Ing. Julián García, zona de Rio IV.
- 02 Autor: Ing. Julián García, zona de Rio IV.
- 03 Autor: Ing. Julián García, zona de Rio IV.
- 04 Autor: Ing. Julián García, zona de Rio IV.
.
Ciclo de la enfermedad
El ciclo de la viruela temprana y tardía es similar. Tanto Cercospora arachidicola como Nothopassalora personata sobreviven en el rastrojo de maní que queda en la superficie o en los primeros centímetros del suelo, como micelio (Frezzi, 1960). En este rastrojo se producen los conidios, que dispersados por las salpicaduras de lluvia y por el viento. Por lo tanto, estos conidios son considerados el inóculo primario y el rastrojo infestado la fuente de inóculo primario. En Argentina no se ha confirmado la detección de ascos y ascosporas, por lo que las formas sexuales no son consideradas como fuente de inóculo primario (March y Marinelli, 2005).
Los conidios son depositados sobre los folíolos de plantas de maní produciendo la infección primaria. En los campos donde se cultiva maní continuamente los residuos o restos culturales (rastrojos) son abundantes, lo que en general, si se dan las condiciones ambientales predisponentes favorecen un desarrollo temprano y rápido de la mancha foliar. Después de un período de incubación que oscila entre 10 y 14 días, aparecen las manchas en las cuales se producen los conidios, que dispersados por el viento, lluvia o riego por aspersión, ocasionan las infecciones secundarias (policíclica). Este ciclo puede repetirse durante el cultivo tantas veces como se den condiciones ambientales favorables (período crítico de infección). Ambos patógenos son capaces de producir enormes cantidades de esporas en las partes infectadas de la planta.
Condiciones predisponentes
Humedad relativa (HR) > 95% (hoja mojada) durante por lo menos 10 hs con temperaturas mínimas de 16 °C (March et al., 1993). La tasa aparente de infección se incrementa correlativamente con la duración del período de humedad y con el incremento de las temperaturas mínimas. En base a estas variables se han desarrollado varios sistemas de pronóstico de la enfermedad (Phipps y Powell, 1984; March et al., 1993; Bailey et al., 1994; Pedro et al., 1994; Wu et al., 1996).
La primera aparición de la mancha foliar y su progreso continuo durante la temporada de crecimiento dependen en gran medida de las condiciones climáticas. Cuando la humedad es adecuada, la temperatura controla la tasa de desarrollo de la enfermedad. Los riegos frecuentes con pequeñas cantidades de agua también promueven el desarrollo de la enfermedad al aumentar los períodos de alta humedad y mojado de las hojas.
Manejo de la enfermedad
Un programa de manejo integrado debe incluir prácticas culturales, resistencia genética y aplicaciones de fungicida. La estrategia de manejo de la enfermedad se basa en disminuir principalmente la tasa epidémica y también el inóculo inicial (March et al., 2010). Actualmente, debido a la falta de variedades de maní resistentes a la enfermedad, el control químico constituye una táctica eficiente para disminuir la tasa epidémica de la viruela. Esta medida conlleva un aumento de los costos de producción. La rotación con otros cultivos ayuda a retrasar la aparición de la enfermedad y retrasar el desarrollo de las manchas foliares. Esta práctica reducen el nivel de inóculo primario en el campo.
Para definir el momento a realizar el primer tratamiento químico es necesario el monitoreo frecuente de la enfermedad para cuantificar la evolución de la intensidad. Se ha establecido experimentalmente en alrededor del 1,5% de severidad como valor de referencia del umbral de daño económico (UDE) para la realización del primer tratamiento (March et al., 2011a,b,c). El monitoreo debe realizarse semanalmente a partir de los 60 – 70 días de la emergencia. Realizado el primer tratamiento, los siguientes se efectúan considerando el período de residualidad del fungicida aplicado, el crecimiento del cultivo y la ocurrencia de las condiciones climáticas favorables.
.
.
.
.
Bibliografía
Anco DJ, Hiers JB, Thomas JS (2020) Improved Management Efficacy of Late Leaf Spot on Peanut Through Combined Application of Prothioconazole with Fluxapyroxad and Pyraclostrobin. Agronomy 10(2): 298. doi: 10.3390/agronomy10020298
Bakhshi M, Zare R (2020) Molecular confirmation of Nothopassalora personata causing leaf spot of peanut in Iran. Australasian Plant Disease Notes 15: 9. doi: 10.1007/s13314-020-0380-3
Cazón LI, Paredes JA, González NR, et al. (2025) Optimizing visual estimation of peanut late leaf spot severity with online training sessions and standard area diagrams. Eur J Plant Pathol. doi: 10.1007/s10658-025-03016-1
Chu Y, Chee P, Culbreath A, et al. (2019) Major QTLs for Resistance to Early and Late Leaf Spot Diseases Are Identified on Chromosomes 3 and 5 in Peanut (Arachis hypogaea). Front Plant Sci. 10:883. doi: 10.3389/fpls.2019.00883
Clevenger J, Chu Y, Chavarro C, et al. (2018) Mapping Late Leaf Spot Resistance in Peanut (Arachis hypogaea) Using QTL-seq Reveals Markers for Marker-Assisted Selection. Front. Plant Sci. 9:83. doi: 10.3389/fpls.2018.00083
Culbreath AK, Stevenson KL, Brenneman TB (2002) Management of late leaf spot of peanut with benomyl and chlorothalonil: A study in preserving fungicide utility. Plant Dis., 86: 349 – 355. https://doi.org/10.1094/PDIS.2002.86.4.349
Culbreath AK, Gevens AJ, Stevenson KL (2018) Relative Effects of Demethylation-Inhibiting Fungicides on Late Leaf Spot of Peanut. Plant Health Progress 19:1, 23-26. https://doi.org/10.1094/PHP-09-17-0053-RS
Flores CR, Habram A, Gómez C, Bejarano S, Rueda N, Rueda E, Ortiz D. (2011) Productos y dosis para el control de la viruela del Maní. INTA C.R. Salta Jujuy, E.E.A. Salta. LINK
Fulmer AM, Mehra LK, Kemerait RC Jr, et al. (2019) Relating Peanut Rx Risk Factors to Epidemics of Early and Late Leaf Spot of Peanut. Plant Disease 103: 3226-3233. https://doi.org/10.1094/PDIS-10-18-1782-RE
Giordano DF, Pastor N, Palacios S, et al. (2021) Peanut leaf spot caused by Nothopassalora personata. Tropical plant pathology 46: 139–151. doi: 10.1007/s40858-020-00411-3
Giordano DF, Pastor NA, Rouws LFM, et al. (2023) Trichoderma harzianum ITEM 3636 colonizes peanut roots as an endophyte and protects the plants against late leaf spot. Symbiosis. doi: 10.1007/s13199-023-00913-z
, , ,
March, G.; C. Oddino; J. García; A. Marinelli y A. Rago (2011) Variación de le eficiencia de fungicidas en el control de la viruela del maní. 2º Congreso Argentino de Fitopatología. Mar del Plata. p: 311.
Marinelli, A.D. y G.J. March (2005) Viruela. En: March, G. y A. Marinelli (eds.). Enfermedades del maní en Argentina. Biglia impresores. Córdoba. p: 13 – 39
Monguillot JH, Lima NB, Paredes JA, et al. (2023) Morphological and molecular characterization of Nothopassalora personata from Argentina. J Plant Pathol. doi: 10.1007/s42161-022-01292-y
Munir M, Wang H, Agudelo P, Anco DJ (2020) Rapid Detection of Fungicide Resistance Phenotypes Among Populations of Nothopassalora personata in South Carolina Peanut Fields. Plant Health Progress 21: 123-132. doi: 10.1094/PHP-12-19-0087-RS
Munir M, Wang H, Dufault NS, Anco DJ (2020) Early Detection of Airborne Inoculum of Nothopassalora personata in Spore Trap Samples from Peanut Fields Using Quantitative PCR. Plants 9(10): 1327. doi: 10.3390/plants9101327
Mushtaq S, Mukhtar T, Afzal A, et al. (2024) Systematic Evaluation of Groundnut Genotypes for Resistance to Cercospora Leaf Spot Disease. International Journal of Phytopathology 13.2: 181-189. doi: 10.33687/phytopath.013.02.5090
Giordano DF, Pastor NA, Rouws LFM, et al. (2023) Trichoderma harzianum ITEM 3636 colonizes peanut roots as an endophyte and protects the plants against late leaf spot. Symbiosis 89: 337–352. doi: 10.1007/s13199-023-00913-z
Oddino, C.; A. Marinelli; G. March; M. Zuza y J. García (2007) Evaluación regional de enfermedades de maní. Campaña 2006/07. XXII Jornada Nacional del Maní y I Simposio de maní del Mercosur. Gral. Cabrera, Cba. p: 10 – 12.
Oddino, C.; A. Marinelli; M. Zuza; J. Garcia y G.J. March (2008) Situación sanitaria regional del maní 2006/07. 1º Congreso Argentino de Fitopatología. Córdoba. 28-30/05/08. p: 158.
Oddino, C.; Ferrari, S.; García, J.; March, G. y Marinelli, A (2009) Efecto de fungicidas foliares sobre la intensidad de la viruela del maní y el rendimiento. Jornadas Fitosanitarias Argentinas. Termas de Río Hondo, Santiago del Estero. Resúmenes. p: PV55.
Renfroe-Becton H, Croft J, Davis C, et al. (2024) Phenotypic Fungicide Resistance and Cross-Resistance Among Nothopassalora personata Populations. PhytoFrontiers 4: 404-415. doi: 10.1094/PHYTOFR-10-23-0137-R
Singh, M. P., Erickson, J. E., Boote, K. J., Tillman, B. J., Jones, J. W., and van Bruggen, A. H. C. (2011). Late leaf spot effects on growth, photosynthesis, and yield in peanut cultivars of differing resistance. Agron. J. 103, 85–91. doi: 10.2134/agronj2010.0322
Videira et al. (2017) Mycosphaerellaceae – Chaos or clarity? Studies in Mycology 87: 257-421. doi: 10.1016/j.simyco.2017.09.003