.
Condición fitosanitaria: Presente
Grupo de cultivos: Frutales de pepita
Especie hospedante: Manzano (Malus domestica), Eriobotrya japónica (níspero japonés)
Rango de hospedantes: específico / estrecho. Infecta Malus domestica y algunas ornamentales emparentadas (Crataegus spp., Pyracantha spp., Eriobotrya japonica, etc.). (*)
Etiología: Hongo. Necrotrófico (considerado hemibiotrófico en una fase inicial)
Agente causal: Venturia inaequalis (teleomorfo), Spilocaea pomi o Fusicladium pomi Bonord. (anamorfo)
Taxonomía: Eukaryota > Fungi > Dikarya > Ascomycota > Pezizomycotina > Dothideomycetes > Dothideomycetes incertae sedis > Venturiales > Venturiaceae > Venturia
.
.
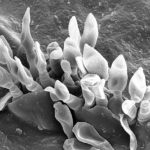
- Micrografía electrónica de barrido (SEM) de conidios flamiformes de Spilocaea pomi a partir de conidióforos cortos que irrumpen a través de la cutícula. Autor: Charles Krause.
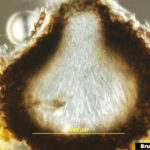
- Pseudotecio inmaduro (sección vertical) sin ascosporas maduras de Venturia inaequalis. Autor: Bruce Watt, University of Maine, Bugwood.org
- Maduración de pseudotecio (sección vertical tangencial) con pocas ascosporas maduras en ascos. Autor: Bruce Watt, University of Maine, Bugwood.org
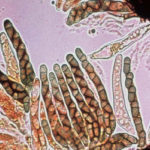
- Pseudotecio abierto de Venturia inaequalis mostrando ascos y ascosporas. Autor: D. Aylor
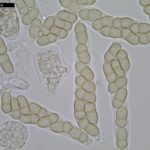
- Ascos y ascosporas de Venturia inaequalis. Autor: Carl Mesarich.
.
(*) Existe cierta controversia con respecto al rango de plantas hospedantes de Venturia spp. en árboles frutales. Varios estudios no han logrado obtener infección de perales por V. inaequalis o la infección de manzanos por V. pyrina. Por ejemplo, Menon (1956) inoculó plantas de manzano y peral con tres tipos de inóculo diferentes de V. inaequalis y V. pyrina (micelio, suspensiones de conidias y suspensiones de ascosporas) y observó síntomas claros de sarna en manzano solo con V. inaequalis y en peral solo con V. pyrina y en ambos casos sólo con conidios o ascosporas. Stehmann et al. (2001) encontraron pseudotecios tanto de V. inaequalis como de V. pyrina en hojas de manzano muertas, pero las inoculaciones cruzadas con las suspensiones conidiales de estos aislados en hojas destacadas de manzano y peral produjeron infección solo cuando el manzano fue inoculado con V. inaequalis y cuando el peral fue inoculado con V. pyrina. Aunque los conidios de V. inaequalis y V. pyrina germinaron sobre ambos hospedantes, y aunque los tubos germinativos produjeron apresorios e hifas ectotróficas en ambos hospedantes, solo se produjo una red subcuticular densa de estroma en el hospedante compatible.
Pyracantha (Pyracantha spp.) y níspero (E. japonica) también se han considerado hospedantes de V. inaequalis. Sin embargo, Le Cam et al. (2002) no pudieron obtener infección de pyracantha por V. inaequalis o infección de manzano por F. pyracanthae. De manera similar, las inoculaciones de níspero con V. inaequalis, V. pyrina o V. carpophila no causaron infección. Las plantas de níspero inoculadas con V. pyrina mostraron síntomas en las hojas, pero los síntomas difirieron de los causados por el hongo de la costra del níspero F. eriobotryae.
Globalmente, los resultados de las inoculaciones cruzadas de Venturia spp. en diferentes hospedantes rosáceos muestran que estos patógenos son hospedante-específicos, y la información contenida en las monografías de Schubert et al. (2003) y Sivanesan (1977) no se pueden reproducir. La especificidad por el hospedante requiere más estudios para F. pyracanthae y F. eriobotryae (González-Domínguez et al., 2017).
.
.
Antecedentes
Fue descripta por primera vez en Suecia, en 1819 y es la enfermedad más importante de manzano y peral en la mayoría de las regiones productoras del mundo, principalmente cuando se presentan lluvias primaverales, en ese caso las pérdidas pueden ser del 70% o más. Las mismas se producen por reducción de calidad del fruto y por defoliación, lo que reduce el crecimiento y rendimiento del árbol durante varios años y aumenta la susceptibilidad a daños en el invierno. Es menos común en regiones semiáridas.
En la República Argentina se detectó por primera vez en 1917 en la provincia de Buenos Aires. Entre las décadas del 1920 al 60 en diferentes localidades de la Provincia de Buenos Aires, Córdoba y Entre Ríos y Provincia de Mendoza (1931): Vista Flores. En 1957 en el Valle Medio del Río Colorado y en 1984 los primeros focos se observaron en el Valle medio del Río Negro y Alto Valle de Río Negro y Neuquén.
.
Distribución Geográfica
Región Alto Valle de Río Negro y Neuquén. Provincia de Río Negro: Coronel J.J. Gómez, Viedma, Villa Regina; Provincia de Jujuy: Depto. General Manuel Belgrano, Hornillos), Tilcara, Yala.
.
Importancia económica
Es la enfermedad más importante de manzano y peral en la mayoría de las regiones productoras del mundo. Las pérdidas de producción varían según las condiciones climáticas de cada temporada particular.
.
.
Sintomatología
Los síntomas son muy semejantes en manzano y peral y pueden aparecer en todos los órganos aéreos de la planta, excepto en las partes lignificadas del árbol.
.
- Autor: Nicholas Streb (KhanLab), Cornell University
- Autor: Nicholas Streb (KhanLab), Cornell University
- Autor: Nicholas Streb (KhanLab), Cornell University
- Autor: Nicholas Streb (KhanLab), Cornell University
.
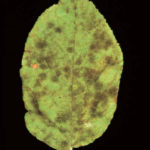
Los primeros síntomas de la enfermedad aparecen en las hojas jóvenes de las yemas florales y en el envés de los sépalos. Se manifiestan por típicas manchas al principio traslúcidas y que luego toman una coloración verde olivácea, de aspecto aterciopelado. Finalmente el tejido afectado se necrosa. Existen dos tipos de manchas, unas más grandes corresponden a las infecciones primarias o ascospóricas y otras más pequeñas que corresponden a las infecciones secundarias o conídicas. El número de lesiones puede variar de uno a numerosas por hoja. Cuando las hojas jóvenes están totalmente cubiertas por la sarna, se marchitan y en pocos días caen del árbol.
Las infecciones en pecíolos y pedicelos resultan en una abscisión prematura de hojas y frutos, respectivamente.
Sobre los frutos se producen manchas similares a las descriptas en las hojas, el tejido infectado se suberiza se oscurece, se vuelve corchoso y se desgarra. Estas fisuras pueden ser puerta de entrada de otros microorganismos. Los ataques en frutos pequeños pueden matar a los tejidos meristemáticos cerca de la superficie de la fruta y las mismas se deforman pues la parte afectada deja de crecer mientras que el área sana crece normalmente. Toda la superficie de la fruta es susceptible a la infección, pero las infecciones tempranas se agrupan generalmente alrededor del cáliz pudiendo ocasionar su caída, mientras que los afectados posteriormente continúan su desarrollo con la consiguiente pérdida del valor comercial. Finalmente se pueden producir ataques tardíos, los cuales con frecuencia pasan desapercibidos en la cosecha, desarrollando síntomas durante el período de conservación.
En las zonas infectadas, sobre las manchas aparece el signo. Este se manifiesta como una eflorescencia olivácea que pasa a pardo-rojizo, constituida por conidióforos cortos, cilíndricos, en cuyo ápice aparece un conidio fusoidal pudiendo ser contínuo o tabicado a la madurez.
.
- Autor: Nicholas J. Brazee
- Autor: Nicholas J. Brazee
- Autor: Nicholas J. Brazee
- Fuente: Department of Primary Industries and Regional Development, Government of Western Australia
- Fuente: Department of Primary Industries and Regional Development, Government of Western Australia
- Autor: Barron, George
- Autor: Rasbak (Netherlands)
- Síntomas de la sarna del manzano en hojas. Fuente: Agrios, 2005.
- Sarna en Latvia. Autor: Aleksandrs Balodis
.
Morfología
El hongo produce ascocarpos (pseudotecios) con un ostíolo incrustado parcialmente en los tejidos de la hoja muerta o en frutos caídos. Los mismos son de forma esférica o subesférica y de color verde oliva o pardo.
Las ascosporas son amarillentas, bicelulares, siendo la célula superior más corta y ancha que la célula inferior, de ahí el nombre de este patógeno. Debajo de la cutícula del hospedante se forman estromas de uno o varios estratos de espesor y de estructura compacta. A partir de este estroma surgen conidióforos en cuyo ápice aparecen conidios flamiformes. El estroma es más grueso en frutos que en hojas.
.
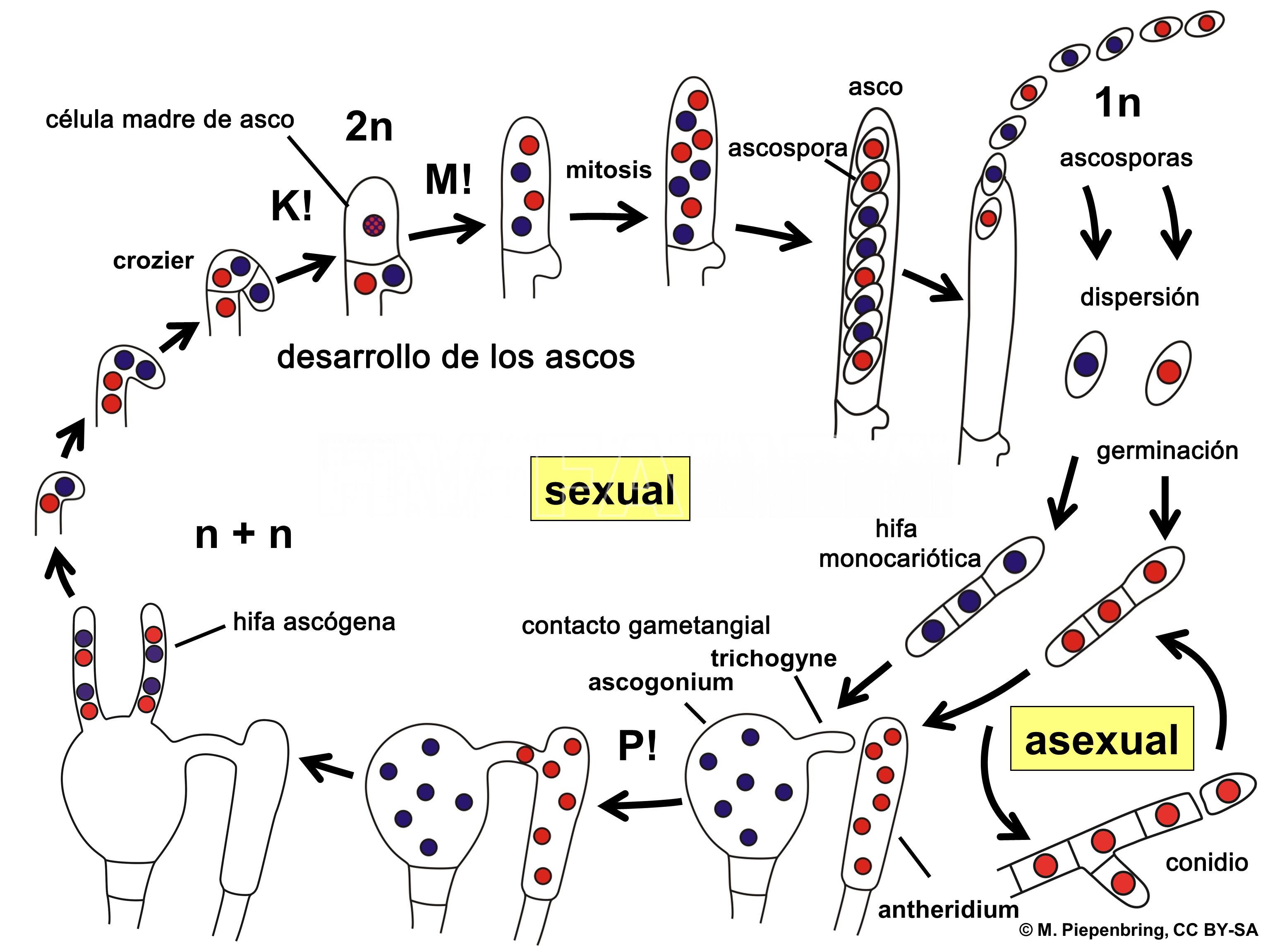
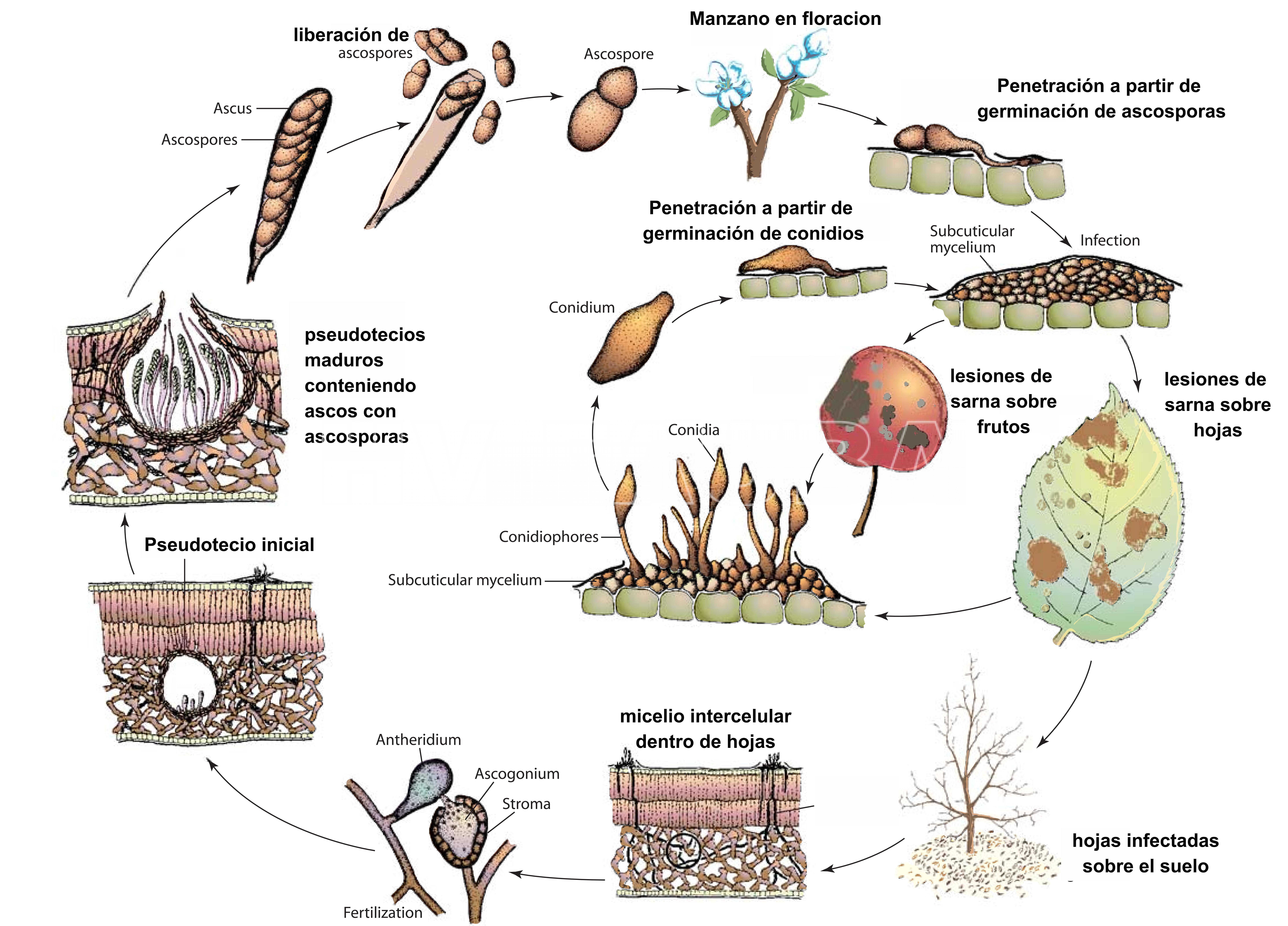
Ciclo de la enfermedad
La etapa de supervivencia del microorganismo se produce como pseudotecio inmaduro en los tejidos del mesófilo de las hojas sobre el suelo, por lo tanto las mismas constituyen la fuente de inóculo primario. En la primavera, el hongo comienza su ciclo de vida arrojando sus ascosporas a través de las aberturas (ostíolo). Las ascosporas son el inóculo primario que dan comienzo a la enfermedad o ciclo primario. Las corrientes de aire las transportan hasta las hojas o frutos del manzano, más susceptibles en su juventud. Cuando las esporas disponen de humedad foliar se produce la germinación, los tubos germinativos que emiten las ascosporas atraviesan la cutícula sin que en apariencia exista un fenómeno de solubilización de ésta y el micelio comienza a crecer formando un estroma subcuticular. Pocos días después de la infección numerosos conidióforos cortos irrumpen a través de la cutícula y cada uno produce en su extremo un conidio. Los conidios se dispersan por las lluvias y llegan a otras hojas o frutos jóvenes. El hongo se propaga asexualmente produciendo varias generaciones conidiales, por lo tanto los conidios o esporas asexuales son el inóculo secundario siendo las lesiones del año la fuente de inóculo secundario, en esta etapa (ciclo secundario) los conidios renuevan el ciclo de la enfermedad durante la primavera y el verano produciendo las infecciones secundarias tantas veces como se den las condiciones climáticas predisponentes.
Ya avanzada la estación de crecimiento, cuando las células de las hojas comienzan a morir, el micelio penetra profundamente dentro de los tejidos. El desarrollo de los pseudotecios, ascos y ascosporas continúa siendo regulado por factores tales como la temperatura y la humedad.
.
- Representación esquemática del ciclo ampliado de vida de un hongo Ascomycota. P! = plasmogamia; K! = cariogamia; M! = meiosis; 2n = células diploides; 1n = células haploides; n + n = células dicarióticas.
- Ciclo de la Sarna del manzano. Fuente: Agrios, 2005.
.
Condiciones predisponentes
Para la maduración de los pseudotecios es necesaria la humedad ambiente. La temperatura óptima para el desarrollo de los pseudotecios es de 8-12ºC, mientras que para la madurez de las ascosporas es de 16-18ºC. Las ascosporas son descargadas por un período de 5 a 9 semanas. Para la germinación de las ascosporas y de los conidios es necesaria una película de agua en la superficie de las hojas o de los frutos y temperatura entre 16 y 23ºC. Se ha comprobado que el número más elevado de ascosporas en el aire ocurre después de las lluvias de octubre-noviembre. El tiempo requerido para la infección es función del número de horas que permanece mojado el follaje por lluvia y de la temperatura promedio de ese período. Las condiciones mínimas son 9 horas de follaje mojado a 16 – 24 ºC de temperatura. Con temperaturas más bajas se necesitan más horas de follaje mojado y por encima de 26 ºC es poco frecuente que se produzcan infecciones.
Par la esporulación es necesario un mínimo de 60-70% de humedad relativa (aunque períodos de menor humedad relativa no son letales para el hongo).
.
Manejo de la enfermedad
Las probabilidades de infección primaria se basan en el número de horas de hoja mojada y la temperatura promedio en un monte con inóculo adecuado.
El manejo de la sarna se basa en la aplicación de prácticas culturales tendientes a desfavorecer el desarrollo del patógeno y en la aplicación de funguicidas. Esta última puede ser en forma preventiva, a calendario fijo ó mediante la utilización de un sistema de alarma.
.
** Prácticas culturales
- Comprenden la eliminación de ramas innecesarias y el apuntalamiento correcto para definir los planos de carga y reducir la altura de las plantas.
- Eliminar o ralear alamedas para permitir la circulación del aire.
- El suelo del interfilar se debe mantener con cobertura verde a baja altura y se debe realizar un manejo adecuado del riego a fin de facilitar la transitabilidad de las pulverizadoras.
.
** Poscosecha
Durante esta etapa se deben tener en cuenta un conjunto de prácticas culturales relacionadas con la disminución de los daños de sarna durante la conservación y la dispersión del inóculo. Se debe evitar la introducción de fruta a la cámara frigorífica con infecciones no visibles y con síntomas de sarna, debido a que la enfermedad continúa su evolución. La limpieza y desinfección de bines tienen por objetivo eliminar todo resto vegetal que lleve inóculo de hongos para evitar su retorno al monte frutal. Las hojas y restos vegetales que se juntan en las plantas de empaque e industrias deben quemarse.
.
** Tratamientos Químicos
Existen dos momentos importantes:
- Tratamientos otoñales
- Destrucción de las formas invernantes del hongo
- Aplicaciones de urea 5%:
- Acelera la caída de las hojas
- Aumenta la actividad bacteriana (descomposición de follaje en el suelo)
- El alto contenido de nitrógeno inhibe el desarrollo de los pseudotecios.
.
- Tratamientos de primavera – verano
- Fungicidas de acción preventiva
- El fungicida debe crear una barrera a la penetración del parásito
- Fungicidas de acción curativa
- Las aplicaciones se realizan una vez que el hongo ha comenzado a penetrar el interior del vegetal atacado.
.
Pueden realizarse según:
- Calendario fijo
En este caso la planta debe estar permanentemente cubierta de funguicida independientemente de las condiciones climáticas. Por ello las aplicaciones se realizan cada 7 días desde puntas verdes hasta que el fruto tiene unos pocos centímetros de diámetro y en adelante, cada 14 días. Se emplean fungicidas de acción protectiva.
- Sistema de pronóstico
En base a las condiciones predisponentes para el período crítico de infección (cantidad de horas de mojado foliar y temperatura) para el desarrollo de la enfermedad, las Tablas de Mills relacionan estos factores, a los que se suman los datos de liberación de ascosporas de las hojas caídas y el estado fenológico del hospedante. Ello posibilita la predicción de un ataque de sarna y la intensidad de la infección.
* Fungicidas preventivos
* Fungicidas de acción curativa
Presíntoma
Postsíntoma
.
El principio es cubrir la planta con funguicida en el momento preciso en que se está por producir una infección o cuando la misma está recién iniciada. Se emplean fungicidas de acción preventiva hasta 24 horas de iniciado el período de follaje mojado, ó de acción curativa una vez iniciada la infección, pero cuanto antes se realice la aplicación mayor será su eficiencia. El tiempo de efecto curativo varía con el tipo de fungicida.
.
.
Bibliografía
Venturia inaequalis. Sistema Nacional Argentino de Vigilancia y Monitoreo de plagas
Agrios G (2005) Plant Pathology. 5th Edition, Elsevier Academic Press, Amsterdam, 952 p. eBook ISBN: 9780080473789
Ayer KM, Villani SM, Choi MW, Cox KD (2019) Characterization of the VisdhC and VisdhD Genes in Venturia inaequalis, and Sensitivity to Fluxapyroxad, Pydiflumetofen, Inpyrfluxam, and Benzovindiflupyr. Plant Disease 103(6): 1092-1100. doi: 10.1094/PDIS-07-18-1225-RE
Bowen JK, Mesarich CH, Bus VGM, et al. (2011) Venturia inaequalis: the causal agent of apple scab. Molecular Plant Pathology 12: 105-122. doi: 10.1111/j.1364-3703.2010.00656.x
Chevalier M, Lespinasse Y, Renaudin S (1991) A microscopic study of the different classes of symptoms coded by the Vf gene in apple for resistance to scab (Venturia inaequalis). Plant Pathology 40: 249-256. doi: 10.1111/j.1365-3059.1991.tb02374.x
Chevalier M, Bernard C, Tellier M, et al. (2004). Host and non-host interaction of Venturia inaequalis and Venturia pirina on Pyrus communis and Malus x domestica. Acta Hortic. 663: 205–208. doi: 10.17660/ActaHortic.2004.663.30
Choupannejad R, Sharifnabi B, Bahar M, Talebi M (2018) Searching for resistance genes to Venturia inaequalis in wild and domestic apples in Iran. Scientia Horticulturae 232: 107-111. doi: 10.1016/j.scienta.2018.01.006
Cova V, Paris R, Toller C, et al. (2017) Apple genes involved in the response to Venturia inaequalis and salicylic acid treatment. Scientia Horticulturae 226: 157-172. doi: 10.1016/j.scienta.2017.08.043
Deng CH, Plummer KM, Jones DAB, et al. (2017 ) Comparative analysis of the predicted secretomes of Rosaceae scab pathogens Venturia inaequalis and V. pirina reveals expanded effector families and putative determinants of host range. BMC Genomics 18(1): 339. doi: 10.1186/s12864-017-3699-1
Gauthier N (2018) Apple scab. The Plant Health Instructor. Updated 2018. Previous version by Vaillancourt, L.J. and J.R. Hartman. doi: 10.1094/PHI-I-2000-1005-01
Gessler C, Patocchi A, Sansavini S, et al. (2006) Venturia inaequalis Resistance in Apple, Critical Reviews in Plant Sciences 25: 473-503. doi: 10.1080/07352680601015975
González-Domínguez E, Armengol J, Rossi V (2017) Biology and Epidemiology of Venturia Species Affecting Fruit Crops: A Review. Frontiers in Plant Science 8: 1496. doi: 10.3389/fpls.2017.01496
Henríquez JL, Oliver SV, Alarcón PC (2011) Sensitivity of Venturia inaequalis Chilean Isolates to Difenoconazole, Fenarimol, Mancozeb and Pyrimethanil. Chilean journal of agricultural research 71(1): 39-44. doi: 10.4067/S0718-58392011000100005
Hoffmeister M, Zito R, Böhm J, et al. (2021) Mutations in Cyp51 of Venturia inaequalis and their effects on DMI sensitivity. J Plant Dis Prot. doi: 10.1007/s41348-021-00516-0
Holb IJ, Heijne B, Withagen JCM, et al. (2005) Analysis of Summer Epidemic Progress of Apple Scab at Different Apple Production Systems in the Netherlands and Hungary. Phytopathology 95(9): 1001-1020. doi: 10.1094/PHYTO-95-1001
Ishii H, Yanase H (2000) Venturia nashicola, the scab fungus of Japanese and Chinese pears: a species distinct from Venturia pirina. Mycol. Res. 104: 755–759. doi: 10.1017/S0953756299001720
Khajuria YP, Kaul S, Wani AA, et al. (2018) Genetics of resistance in apple against Venturia inaequalis (Wint.) Cke. Tree Genetics & Genomes 14:16. doi: 10.1007/s11295-018-1226-4
Kunz S, Lutz B, Deising H, Mendgen K (1998) Assessment of sensitivities to anilinopyrimidine- and strobilurin-fungicides in populations of the apple scab fungus Venturia inaequalis. J. Phytopathol. 146: 231-238. doi: 10.1111/j.1439-0434.1998.tb04684.x
Le Cam B, Sargent D, Gouzy J, et al. (2019) Population Genome Sequencing of the Scab Fungal Species Venturia inaequalis, Venturia pirina, Venturia aucupariae and Venturia asperata. G3 (Bethesda) 9(8): 2405-2414. doi: 10.1534/g3.119.400047
Li X, Li H, Yu Z, et al. (2021) Investigating the sensitivity of Venturia inaequalis isolates to difenoconazole and pyraclostrobin in apple orchards in China. Eur J Plant Pathol 161: 207–217. doi: 10.1007/s10658-021-02316-6
Lucero H, Linardelli C, Lucero G, et al. (2003) Sarna del Manzano: detección de la forma sexual (Venturia inaequalis) en Mendoza (Argentina). Página/s: 63-66.
MacHardy WE, Gadoury DM (1989) A revision of Mills’ criteria for predicting apple scab infection periods. Phytopathology 79: 304-301. doi: 10.1094/Phyto-79-304
Mansoor S, Ahmed N, Sharma V, et al. (2019) Elucidating genetic variability and population structure in Venturia inaequalis associated with apple scab diseaseusing SSR markers. PLoS ONE 14(11): e0224300. doi: 10.1371/journal.pone.0224300
Martínez É, Alaniz S, Mondino P (2021) Release dynamics of Venturia inaequalis ascospores in Uruguay. Trop. plant pathol. 46: 414–421. doi: 10.1007/s40858-021-00434-4
Mellon I, Singh J, Feulner H, Khan A (2023) Genetic variation and population differentiation in North American, Central Asian and European isolates of Venturia inaequalis. Plant Pathol. doi: 10.1111/ppa.13772
Menon, R. (1956). Studies on Venturiaceae on rosaceous plants. Phytopathol. Z. 27, 117–146.
Michalecka M, Masny S, Leroy T, Puławska J (2018) Population structure of Venturia inaequalis, a causal agent of apple scab, in response to heterogeneous apple tree cultivation. BMC Evolutionary Biology 18:5. doi: 10.1186/s12862-018-1122-4
Mills WD (1944) Efficient use of sulfur dusts and sprays during rain to control apple scab. Cornell Ext. Bull. 630. 4 pp
Muchembled J, Deweer C, Sahmer K, Halama P (2017) Antifungal activity of essential oils on two Venturia inaequalis strains with different sensitivities to tebuconazole. Environmental Science and Pollution Research 1–8. doi: 10.1007/s11356-017-0507-z
Nasonov AI, Yakuba GV (2024) Apple Scab: Resistance to Chemical Fungicides. Biol Bull Rev 14 (Suppl 1): S17–S30. doi: 10.1134/S2079086424600802
Okoro CA, El-Hasan A, Voegele RT (2024) Integrating Biological Control Agents for Enhanced Management of Apple Scab (Venturia inaequalis): Insights, Risks, Challenges, and Prospects. Agrochemicals 3(2): 118-146. doi: 10.3390/agrochemicals3020010
Parisi L, Lespinasse Y, Guillaumes J, Krüger J (1993) A New Race of Venturia inaequalis Virulent to Apples with Resistance due to the Vf Gene. Phytopathology 83: 533-537. doi: 10.1094/Phyto-83-533
Parisi L, Guillaumès J, Lespinasse Y, Krüger J (1994) A new race of Venturia inaequalis virulent to apples with resistance due to the Vf gene. In: Schmidt H., Kellerhals M. (eds) Progress in Temperate Fruit Breeding. Developments in Plant Breeding, vol 1. Springer, Dordrecht. doi: 10.1007/978-94-011-0467-8_16
Peil, A., Patocchi, A., Hanke, MV. et al. (2018) Apple cultivar Regia possessing both Rvi2 and Rvi4 resistance genes is the source of a new race of Venturia inaequalis. European Journal of Plant Pathology 151(2): 533–539. doi: 10.1007/s10658-017-1383-6
Percival GC, Noviss K, Haynes I (2009) Field evaluation of systemic inducing resistance chemicals at different growth stages for the control of apple (Venturia inaequalis) and pear (Venturia pirina) scab. Crop Protection 28(8): 629-633. doi: 10.1016/j.cropro.2009.03.010
Raabe R, Gardner MW (1972) Scab of pyracantha, loquat, toyon and kageneckia. Phytopathology 62: 914–916. doi: 10.1094/Phyto-62-914
, , , et al. (2022) A new highly effective hybrid fungicide containing difenoconazole and tea tree oil for managing scab of apple, pecan and almond trees and as a tool in resistance management. Plant Pathology 71: 1774– 1783. doi: 10.1111/ppa.13610
Rocafort M, Bowen JK, Hassing B, et al. (2022) The Venturia inaequalis effector repertoire is dominated by expanded families with predicted structural similarity, but unrelated sequence, to avirulence proteins from other plant-pathogenic fungi. BMC Biol 20: 246. doi: 10.1186/s12915-022-01442-9
(2023) Cell Wall Carbohydrate Dynamics during the Differentiation of Infection Structures by the Apple Scab Fungus, Venturia inaequalis. Microbiol Spectr 11: e04219-22. doi: 10.1128/spectrum.04219-22
Sánchez-Torres P, Hinarejos R, Tuset JJ (2007) Fusicladium eriobotryae: hongo causante del moteado del níspero en el Mediterráneo español. Bol. San. Veg. Plagas 33: 89–98.
Sánchez-Torres P, Hinarejos R, Tuset JJ (2007) Identification and characterization of Fusicladium eriobotryae: fungal pathogen causing mediterranean loquat scab. Acta Hortic. 33, 343–347. doi: 10.17660/ActaHortic.2007.750.54
Sánchez-Torres P, Hinarejos R, Tuset JJ (2009) Characterization and pathogenicity of Fusicladium eriobotryae, the fungal pathogen responsible for loquat scab. Plant Disease 93: 1151–1157. doi: 10.1094/PDIS-93-11-1151
Schubert KS, Ritschel AR, Braun UB (2003) A monograph of Fusicladium s. lat. (Hyphomycetes). Schlechtendalia 9: 1–132.
Shen M, Zhang JQ, Zhao LL, et al. (2020) Venturiales. Studies in Mycology 96: 185-308. doi: 10.1016/j.simyco.2020.03.001
Singh KP, Kumar J, Singh A, et al. (2016) Maturation, Ascospores Discharge Pattern and Relevance of Mills Criteria for Predicting Apple Scab Infection Period in India. Plant Pathology Journal 15: 108-123. doi: 10.3923/ppj.2016.108.123
Sitther V, Garrido Haro PA, Molineros JE, et al. (2018) Genetic diversity of apple‐ and crabapple‐infecting isolates of Venturia inaequalis in Pennsylvania, the United States, determined by microsatellite markers. Forest Pathology 48: e12405. doi: 10.1111/efp.12405
Sivanesan A (1977) The Taxonomy and Pathology of Venturia Species. Bibliotheca Mycologica. Vaduz: Lubrecht and Cramer Ltd.
Stehmann C, Pennycook S, Plummer KM (2001) Molecular identification of a sexual interloper: the pear pathogen, Venturia pirina, has sex on apple. Phytopathology 91: 633–641. doi: 10.1094/PHYTO.2001.91.7.633
Steiner U, Oerke EC (2007) Localized Melanization of Appressoria Is Required for Pathogenicity of Venturia inaequalis. Phytopathology 97(10): 1222–1230. doi: 10.1094/PHYTO-97-10-1222
Steiner U, Oerke E-C (2023) A Melanin-Deficient Isolate of Venturia inaequalis Reveals Various Roles of Melanin in Pathogen Life Cycle and Fitness. Journal of Fungi 9(1): 35. doi: 10.3390/jof9010035
Steiner U, Oerke E-C (2024) The Hemibiotrophic Apple Scab Fungus Venturia inaequalis Induces a Biotrophic Interface but Lacks a Necrotrophic Stage. Journal of Fungi 10(12): 831. doi: 10.3390/jof10120831