.
Condición fitosanitaria: Presente
Grupo de cultivos: Hortícolas
Especie hospedante: Frutilla (Fragaria × ananassa (Weston) Duchesne ex Rozier)
Rango de hospedantes: amplio, no específico
Etiología: Hongo. Necrotrófico
Agente causal: Colletotrichum spp Corda, 1831, incluyendo C. acutatum, C. gloeosporioides, C. fragariae. Las tres especies pueden estar asociadas con la antracnosis de la frutilla. Sin embargo, C. acutatum es el principal patógeno asociado con la fase de pudrición del fruto por antracnosis.
Taxonomía: Fungi > Dikarya > Ascomycota > Pezizomycotina > Sordariomycetes > Hypocreomycetidae > Glomerellales > Glomerellaceae > Colletotrichum
.
.
Antecedentes
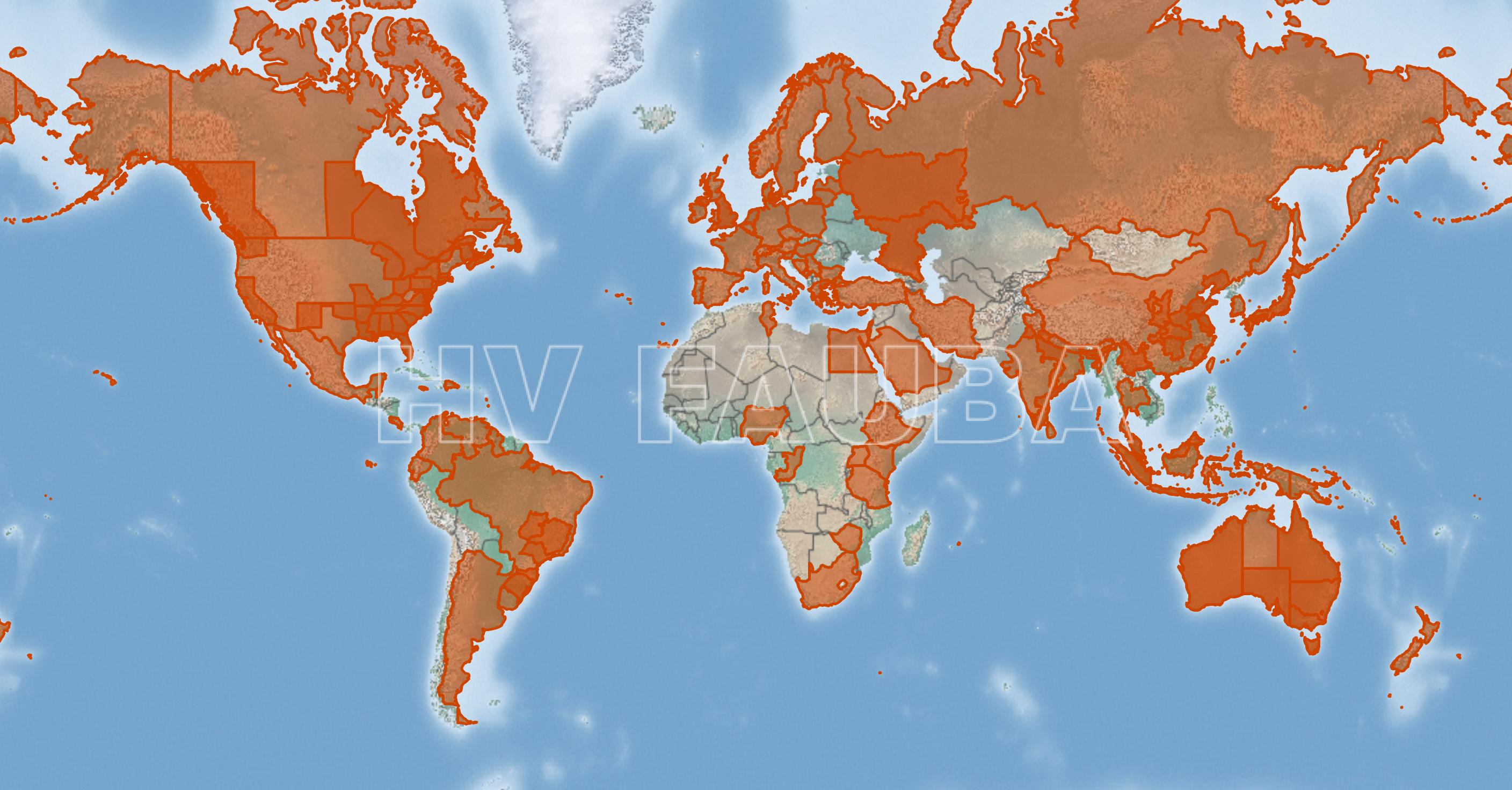
- Distribución mundial (prevalencia) de Colletotrichum acutatum. Fuente: www.cabi.org
.
.
Síntomas
La pudrición de la fruta por antracnosis inicia como manchas empapadas de agua de color marrón a negro en la fruta verde y madura. Se pueden desarrollar lesiones firmes, hundidas, de color marrón a negro, con el tiempo, dependiendo de la humedad relativa prevalente en el momento del desarrollo de la enfermedad. Se pueden formar masas de esporas de color rosa, salmón o naranja en la lesión en condiciones de humedad, donde las lesiones pueden parecer menos hundidas y parduscas. En condiciones secas, las lesiones aparecen más hundidas y negras y toda la fruta puede secarse para momificarse. Las yemas, pedicelos, pedúnculos y flores de la mayoría de los cultivares son susceptibles a C. acutatum. Las flores también pueden morir y secarse. Si la infección ocurre poco después de la polinización, la fruta en desarrollo permanece pequeña, dura y deformada. El patógeno también puede llegar a la zona de las raíces y causar lesiones negras en las raíces. Las puntas infectadas pueden provocar infecciones generalizadas en el tejido joven de las plantas y la muerte de plantas. El tejido infectado colocado en una cámara de incubación esporulará en 24 horas. Los síntomas también pueden confundirse con la pudrición de la fruta por Alternaria, o por Phomopsis, o la pudrición seca por Rhizoctonia, o el daño por granizo, pero la combinación de signos (esporas) y síntomas es diagnóstica de esta enfermedad.
.
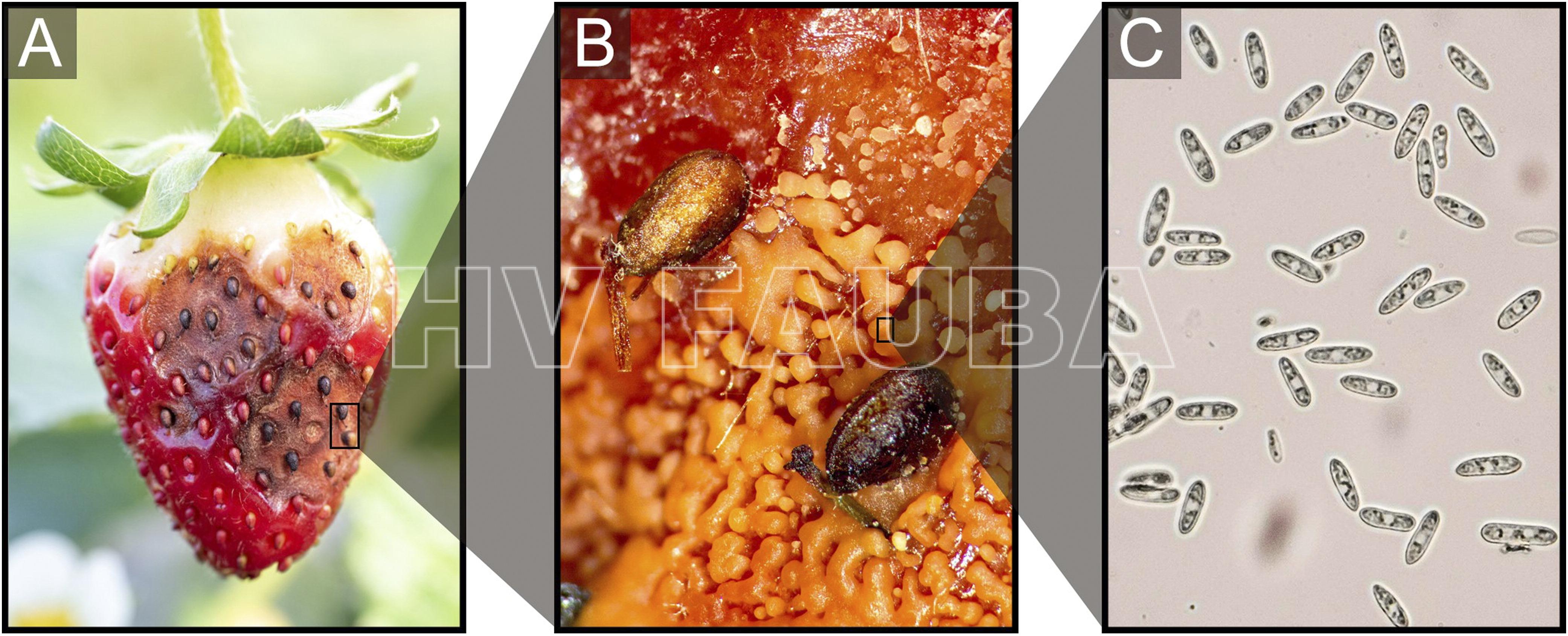
- Síntomas y signos de pudrición de frutilla por antracnosis causado por Colletotrichum spp. (A) frutilla madura infectada por C. acutatum; (B) imagen con lupa de masas de esporas (conidios) en matriz mucilaginosa de C. acutatum en una lesión de antracnosis; (C) imagen microscópica de esporas (conidios) de C. acutatum. Autor: Dowling et al., 2020.
.
- Autor: Frank J. Louws, NCSU
- Autor: Frank J. Louws, NCSU
- Autor: Frank J. Louws, NCSU
- Autor: Garrett Ridge
,
Ciclo de la enfermedad, condiciones ambientales predisponentes y epidemiología
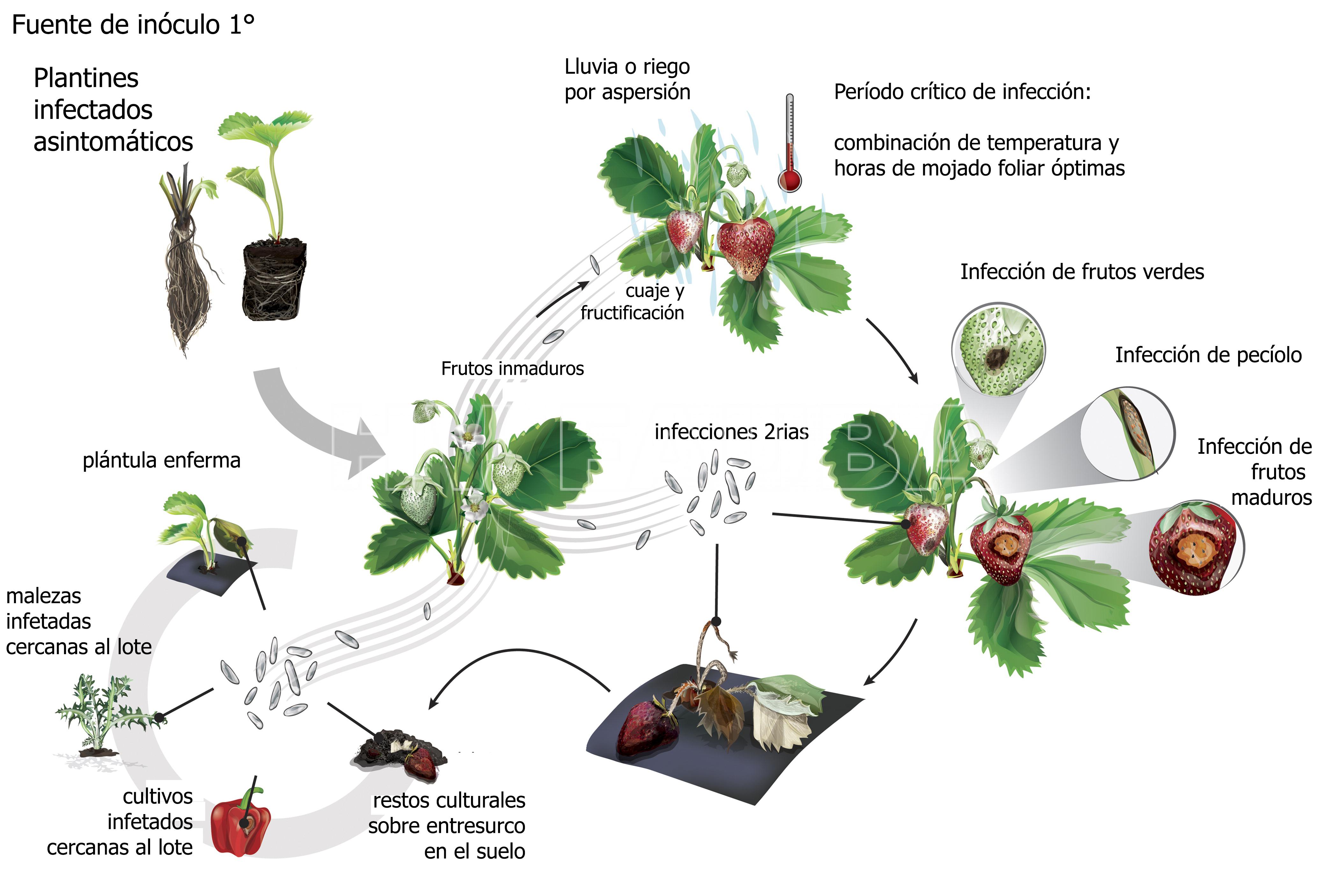
La fuente principal de inóculo primario ingresa a los campos en los trasplantes de frutilla. El patógeno puede crecer en tejido verde, incluso sin mostrar ningún síntoma, luego permanecer inactivo o incluso producir esporas. Cuando el tejido verde muere, el hongo se activa y puede esporular abundantemente. C. acutatum sobrevive en restos de plantas hasta nueve meses, y puede infectar varios hospedantes secundarios, como las malezas que crecen a lo largo del campo. El patógeno también puede sobrevivir en tejido vegetal vivo durante el verano. Sin embargo, en general los plantines de frutilla infectados son la principal fuente de inóculo primario. Los pimientos con antracnosis, causada por la misma especie, también pueden representar una amenaza.
Los conidios se producen en abundancia en los pecíolos, estolones y frutos, y se dispersan a través de las salpicaduras de lluvia, especialmente la lluvia impulsada por el viento. El movimiento de maquinaria y trabajadores por el campo también puede contribuir a la diseminación del inóculo secundario. Las condiciones cálidas y húmedas son óptimas para esta enfermedad, por lo que se deben utilizar prácticas culturales que fomenten la aireación y el secado rápido de la fruta. Los mantillos de paja pueden ayudar a reducir la dispersión de esporas en las salpicaduras de agua, pero los mantillos de plástico (mulching) proporcionan un trampolín para las gotas, lo que fomenta la propagación de enfermedades. El riego por aspersión también puede contribuir a la propagación de enfermedades.
.
- Ciclo de la antracnosis de la frutilla. Autor: Dowling et al., 2020.
.
.
Manejo Integrado de la enfermedad
1. Usar plantines libres de enfermedades
2. Cultivares resistentes (cuando estuvieran disponibles)
3. Monitoreo
4. Rotación
5. Control Químico
6. Control Biológico
.
.
VIDEO Strawberry Diagnostics: Anthracnose fruit rot (Colletotrichum acutatum)
.
Strawberry Diagnostic Key (NCSU)
.
Bibliografía
Baroncelli R, Zapparata A, Sarrocco S, et al. (2015) Molecular Diversity of Anthracnose Pathogen Populations Associated with UK Strawberry Production Suggests Multiple Introductions of Three Different Colletotrichum Species. PLoS ONE 10(6): e0129140. doi: 10.1371/journal.pone.0129140
Baroncelli R, Talhinhas P, Pensec F, et al. (2017) The Colletotrichum acutatum Species Complex as a Model System to Study Evolution and Host Specialization in Plant Pathogens. Front. Microbiol. 8: 2001. doi: 10.3389/fmicb.2017.02001
, , , et al. (2022) Genome evolution and transcriptome plasticity associated with adaptation to monocot and eudicot plants in Colletotrichum fungi. bioRxiv 2022.09.22.508453; doi: 10.1101/2022.09.22.508453
Damm U, Cannon P, Woudenberg J, Crous P (2012) The Colletotrichum acutatum species complex. Studies in Mycology 73: 37–113. doi: 10.3114/sim0010
Dowling M, Peres N, Villani S, Schnabel G (2020) Managing Colletotrichum on Fruit Crops: A «Complex» Challenge. Plant Disease 104(9): 2301-2316. doi: 10.1094/PDIS-11-19-2378-FE
, , , et al. (2021) HSP17.4 mediates salicylic acid and jasmonic acid pathways in the regulation of resistance to Colletotrichum gloeosporioides in strawberry. Mol Plant Pathol. 22: 817– 828. doi: 10.1111/mpp.13065
Garrido C, Carbú M, Fernández-Acero FJ, et al. (2009) Phylogenetic relationships and genome organisation of Colletotrichum acutatum causing anthracnose in strawberry. European Journal of Plant Pathology 125: 397–411. doi: 10.1007/s10658-009-9489-0
Gunnell PS, Gubler WD (1992) Taxonomy and morphology of Colletotrichum species pathogenic to strawberry. Mycologia 84:157–165. doi: 10.1080/00275514.1992.12026122
Harp T, Kuhn P, Roberts PD, et al. (2014) Management and cross-infectivity potential of Colletotrichum acutatum causing anthracnose on bell pepper in Florida. Phytoparasitica 42: 31–39. doi: 10.1007/s12600-013-0334-9
, (2023) Appressorium formation is regulated by the Msb2– and Sho1-dependent hierarchical transcriptional network in Colletotrichum gloeosporioides. Plant Pathology 00: 1–15. doi: 10.1111/ppa.13822
MacKenzie SJ, Peres NA (2012) Use of leaf wetness and temperature to time fungicide applications to control anthracnose fruit rot of strawberry in Florida. Plant Disease 96: 522–528. doi: 10.1094/PDIS-03-11-0181
Peres NA, Timmer LW, Adaskaveg JE, Correll JC (2005) Lifestyles of Colletotrichum acutatum. Plant Disease 89: 784–796. doi: 10.1094/PD-89-0784
Reveglia P, Agudo-Jurado FJ, Barilli E, et al. (2023) Uncovering Phytotoxic Compounds Produced by Colletotrichum spp. Involved in Legume Diseases Using an OSMAC–Metabolomics Approach. Journal of Fungi. 9(6): 610. doi: 10.3390/jof9060610
Smith BJ (1998) Anthracnose Fruit Rot (Black Spot). Pp. 31-33 in: Compendium of Strawberry Diseases, 2nd edition, Maas, J. L. (ed.). APS Press. St. Paul, MN.
Smith BJ (2008) Epidemiology and Pathology of Strawberry Anthracnose: A North American Perspective. HortScience horts 43: 69-73. LINK
Talhinhas P, Baroncelli R (2021) Colletotrichum species and complexes: geographic distribution, host range and conservation status. Fungal Diversity 110: 109–198. doi: 10.1007/s13225-021-00491-9
Zhang X, Gleason M, Nonnecke G, Peres N (2015) Strawberry anthracnose: managing a hidden menace. The Plant Health Instructor. doi: 10.1094/PHI-T-2015-1015-01