.
Condición fitosanitaria: Presente
Grupo de cultivos: Hortícolas
Especie hospedante: Tomate (Solanum lycopersicum L.)
Rango de hospedantes: amplio
Etiología: Hongo. Necrotrófico
Agente causal: Geotrichum candidum Link, 1809
syn. Dipodascus geotrichum (EE Butler y LJ Petersen) Arx
.
Taxonomía: Fungi > Dikarya > Ascomycota > Saccharomycotina > Saccharomycetes > Saccharomycetales > Dipodascaceae > Geotrichum
.
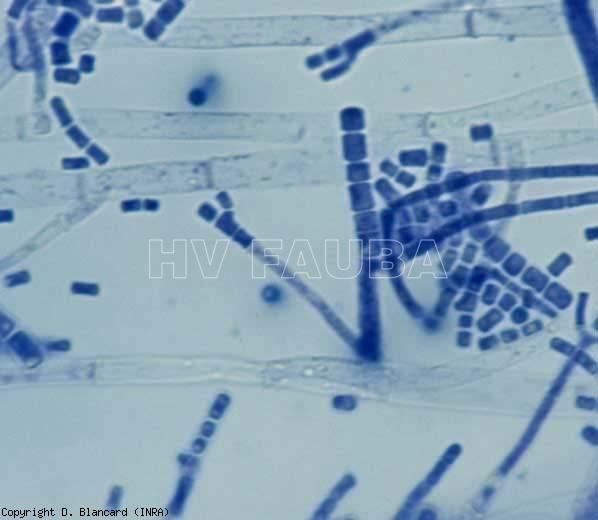
Geotrichum forma micelios tabicados que se fragmentan fácilmente en artrosporas (conidios), que son el principal medio de reproducción del organismo.
.
- Conidios en conidióforos de Geotrichum candidum. Autor: D. Blancard, INRA
.
.
Antecedentes
La podredumbre ácida es una problemática bastante corriente en poscosecha de tomate junto con Rhizopus. La enfermedad es causada por Geotrichum candidum, un hongo común del suelo que causa la podredumbre agria de tomates, frutas cítricas y verduras, y es un contaminante importante en los equipos de procesamiento de tomate. G. candidum es un hongo filamentoso parecido a una levadura. Es un organismo ubicuo que se encuentra en una variedad de hábitats, incluidos el aire, el agua, el ensilado y el suelo (Butler y Eckert, 1962, O’Brien et al., 2005) y también en alimentos como la leche, el queso y los productos lácteos fermentados (Boutrou y Guégen, 2005, Marcellino et al., 2001, Pottier et al., 2008).
Como componente de la microbiota normal del tracto digestivo humano, se ha informado, aunque con poca frecuencia, como agente infeccioso en pacientes inmunocomprometidos (Vasei y Imanieh, 1999; Verghese y Ravichandran, 2003; André et al., 2004; Sfakianakis et al., 2007; Henrich et al., 2009).
Como patógeno de las plantas, G. candidum provoca la podredumbre agria de los cítricos, tomates, zanahorias y otras frutas y verduras (Pitt y Hocking, 2009). Las más susceptibles a la infección son las frutas y verduras maduras o demasiado maduras, en particular las que se conservan en envases que conservan la humedad y los tejidos heridos (Moline, 1984). La descomposición se propaga rápidamente, dando como resultado una masa acuosa de olor agrio. Si bien el hongo prefiere altas temperaturas y humedad, es activo a temperaturas tan bajas como 2 °C. En consecuencia, el hongo es un importante patógeno de almacenamiento poscosecha (Oladiran e Iwu, 1993). Además, G. candidum es el contaminante predominante en los equipos de procesamiento de tomate y se le conoce como “moho de maquinaria” (Splittstoesser et al., 2006).
.
Sintomatología
La enfermedad se caracteriza por la presencia de lesiones húmedas que aparecen a nivel de heridas o cicatriz peduncular de los frutos. Un olor ácido característico acompaña a esta podredumbre, lo que refleja un pH relativamente bajo de la pulpa de la fruta, del orden de 4. Estas lesiones evolucionan rápidamente sobre frutos maduros, cuya epidermis acaba por partirse, provocando que el jugo fluya hacia el exterior. Un moco blanquecino y denso (signo) a veces cubre los tejidos localmente, lo que corresponde al desarrollo de colonias de G. candidum. Dentro de este último, las artrosporas son fácilmente observables al microscopio óptico.
.
- Autor: Claudio Baron
- Autor: Claudio Baron
.
Condiciones predisponentes
La temperatura óptima para el crecimiento micelial y germinación de conidias de G. candidum es de 25 °C, mientras que este patógeno también es muy activo a temperaturas entre 15 y 30°C. La incubación a 40°C inhibe el crecimiento micelial y la germinación conidial de G. candidum (Thomidis et al., 2021). Los conidios germinan después de un período de incubación de 8 h y con un mayor porcentaje después de 16 h.
.
Manejo Integrado
Control Químico. Propiconazole es un ingrediente activo efectivo contra este patógeno (Thomidis et al., 2021). Sin embargo, este fungicida no está registrado aún para tomate en Argentina. Pueden usarse Tebuconazole y Tetraconazole. En contraste, fludioxonil no es un i.a. efectivo contra este patógeno.
.
.
.
Bibliografía
Sour rot of tomato. University of Florida
André N, Coze C, Gentet JC, et al. (2004) Geotrichum candidum septicemia in a child with hepatoblastoma. Pediatr Infect Dis J. 23(1): 86. doi: 10.1097/01.inf.0000107293.89025.a8
Bourret TB, Kramer EK, Rogers JD, Glawe DA (2013) Isolation of Geotrichum candidum pathogenic to tomato (Solanum lycopersicum) in Washington State. North American Fungi 8:1. doi: 10.2509/naf2013.008.014
Boutrou R, Guéguen M (2005) Interests in Geotrichum candidum for cheese technology. Int J Food Microbiol. 102(1): 1-20. doi: 10.1016/j.ijfoodmicro.2004.12.028
Butler EE, Eckert JW (1962) A sensitive method for the isolation of Geotrichum candidum from soil. Mycologia, 54: 106-109. doi: 10.2307/3756605
Escalona Contreras VH, San Martín JC, González Olivares A (2019) Manejo postcosecha de tomates y pimientos frescos y de IV gama. Serie Ciencias Agronómicas 32. Universidad de Chile. Link
Henrich TJ, Marty FM, Milner DA, Thorner AR (2009) Disseminated Geotrichum candidum infection in a patient with relapsed acute myelogenous leukemia following allogeneic stem cell transplantation and review of the literature. Transplant Infectious Diseases 11: 458-462. doi: 10.1111/j.1399-3062.2009.00418.x
Marcellino N, Beuvier E, Grappin R, et al. (2001) Diversity of Geotrichum candidum strains isolated from traditional cheese making fabrications in France. Applied and Environmental Microbiology 67: 4752-4759. doi: 10.1128/AEM.67.10.4752-4759.2001
Moline HE (1984) Comparative studies with two Geotrichum species inciting post harvest decays of tomato fruit. Plant Disease 68: 46-48. doi: 10.1094/PD-68-46
Thornton CR, Slaughter DC, Davis RM (2010) Detection of the sour-rot pathogen Geotrichum candidum in tomato fruit and juice by using a highly specific monoclonal antibody-based ELISA. Int J Food Microbiol. 143(3): 166-172. doi: 10.1016/j.ijfoodmicro.2010.08.012