.
Condición fitosanitaria: Presente
Grupo de cultivos: Hortícolas
Especie hospedante: Papa (Solanum tuberosum L.)
Rango de hospedantes: no específico / amplio. Es un hongo polífago que tiene un amplio rango de hospedantes, tiene la capacidad de infectar aproximadamente a 100 familias, con más de 500 hospedantes.
Etiología: Hongo. Necrotrófico, con capacidad de supervivencia en el suelo.
Agente causal: Sclerotium rolfsii (Sacc.) West. (anamorfo) / Athelia rolfsii (teleomorfo)
Sclerotium rolfsii es la fase anamórfica del patógeno que se encuentra bajo el grupo Incertae sedis, ya que su clasificación es controvertida debido a que la etapa teliomórfica, es decir, la etapa sexual se observa raramente. El teleomorfo Athelia rolfsii (Curzi) C.C. Tu & Kimbr. es un basidiomycota, que se clasifica de la siguiente manera:
.
Taxonomía: Eukaryota > Fungi > Dikarya > Basidiomycota > Agaricomycotina > Agaricomycetes > Atheliales > Atheliaceae > Athelia
.
S. rolfsii no forma esporas ni estructuras fructíferas asexuales. El hongo forma esclerocios que comienzan a formarse como pequeños mechones de micelio blanco que forman esclerocios esféricos de 0,5 a 1,5 mm de diámetro. Los esclerocios se oscurecen a medida que maduran y se vuelven de color canela a marrón oscuro. Estos esclerocios permiten que el hongo sobreviva durante largos períodos en los restos culturales de plantas y el suelo.
Es común observar en el micelio la conexión de abrazadera (fíbula). La fíbula, también llamada conexión en fíbula (unión en fíbula), en abrazadera o clamp (del inglés: clamp connection), es una estructura que se encuentra en muchas especies de basidiomicetos y que se produce entre dos células binucleadas adyacentes de una misma hifa. Esta estructura contribuye a que durante la mitosis de una célula con dos núcleos (A y B), las copias de ambos núcleos (A’ y B’) se mantengan en la nueva célula.
.
.
.
Antecedentes
S. rolfsii ataca muchos cultivos de grano (ej. maní, soja) y hortícolas (ej. tomate, repollo) en regiones cálidas. El hongo persiste en el suelo entre cultivos. La germinación y la infección por los esclerocios se ven favorecidas por las altas temperaturas (25° a 30°F) y las superficies húmedas del suelo. La pudrición del tallo de la papa se considera un problema solo en áreas de cultivo de clima cálido. Las pérdidas suelen ocurrir al final de la temporada. Las pérdidas extensas de tubérculos pueden iniciarse a los pocos días de la cosecha si el hongo está presente. Los cultivares de papa varían en su grado de susceptibilidad pero los cultivares actuales no han sido bien clasificados.
En el caso de una contaminación severa del suelo, pueden ocurrir grandes pérdidas de tubérculos cuando, durante el período de crecimiento, las condiciones climáticas han sido favorables para el desarrollo de enfermedades. En tales condiciones, se recomienda la rotación con cultivos no hospedantes.
.
Sintomatología
Los tallos afectados primero muestran una descomposición húmeda o ligeramente por debajo de la superficie del suelo donde se inicia la infección. Las lesiones del tallo se expanden hacia arriba y hacia abajo del tallo y todas las partes de la planta pueden infectarse. La infección del tallo conduce al marchitamiento y amarillamiento del follaje. Los tubérculos se infectan típicamente a través de los estolones. El hongo crece rápidamente sobre la superficie del tubérculo e invade los tejidos (colonización), dando como resultado una descomposición húmeda. Las partes de la planta infectadas y el suelo cercano a menudo se cubren con el micelio blanco y radiante de S. rolfsii (signo). El micelio genera pequeños esclerocios esféricos (alrededor de 1 a 2 mm de diámetro) que son blancos cuando son jóvenes y marrones cuando maduran.
Una vez cosechados y almacenados, los tubérculos infectados muestran síntomas espectaculares de numerosos esclerocios que brotan de los tubérculos podridos.
.
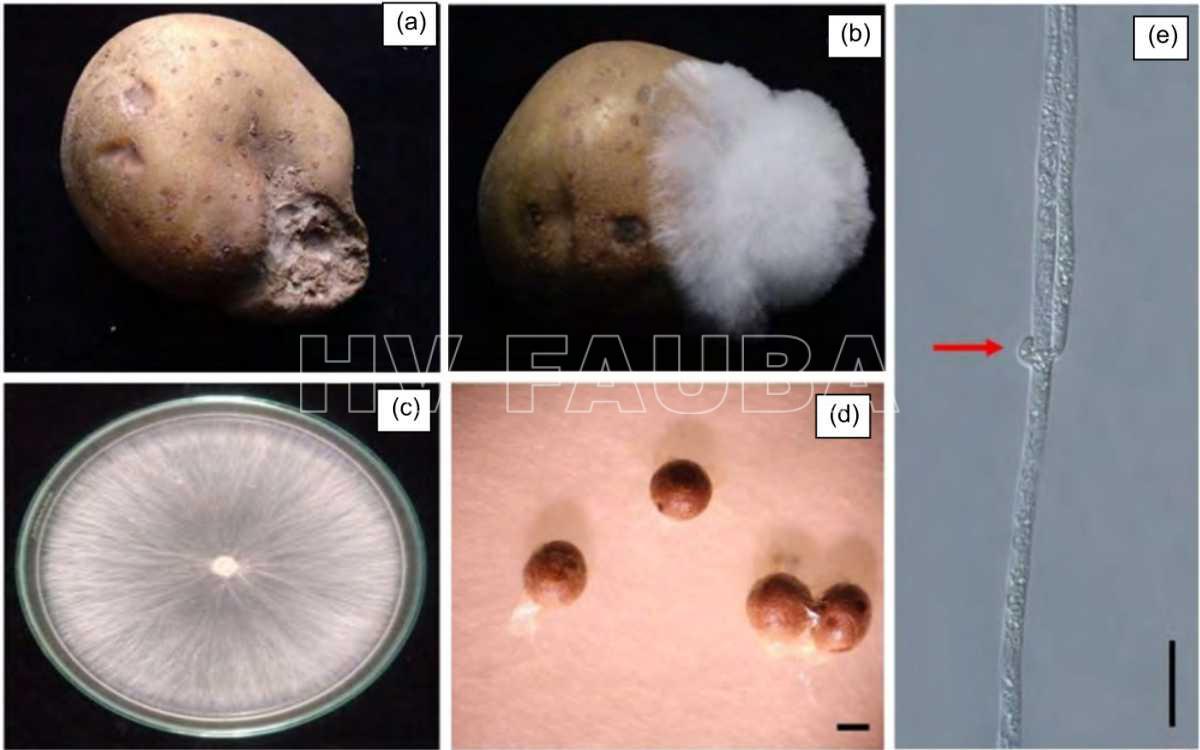
- Síntomas de la enfermedad y morfología de Sclerotium rolfsii. (a) Síntoma en tubérculo de papa cv. ‘Atlantic’ recolectado del campo. (b) Crecimiento micelial en tubérculo de papa cv. ‘Atlántico’, 2 dpi en una cámara húmeda. (c) Crecimiento micelial de 3 días en agar papa dextrosa (PDA). (d) Esclerocios formados 15 dpi en PDA (barra de escala = 100 μm). (e) Conexión de abrazadera (fíbula) formada en la hifa (barra de escala = 50 μm). Autor: Matnork et al., 2021
.
Manejo Integrado
* La siembra relativamente temprana minimiza la pudrición de tallos y tubérculos al evitar las altas temperaturas de finales de temporada que favorecen la enfermedad. Plantar los campos infestados con S. rolfsii antes de plantar los campos sin infestación.
* No almacenar tubérculos en el suelo innecesariamente mucho antes de la cosecha. Esto aumenta la probabilidad de infección a temperaturas cálidas favorables, al exponer el inóculo por más tiempo al hospedante.
* Rotar cultivos que sean menos susceptibles (p. ej., evitar cultivos carnosos, como los tubérculos).
* Se recomienda la fumigación previa a la plantación con metam sodio para los campos que se sabe que están infestados con S. rolfsii. Este tratamiento proporciona un buen control durante al menos una campaña agrícola. Las aplicaciones de bicarbonato de amonio para mejorar el suelo realizadas justo antes de la cosecha matan el micelio, pero no los esclerocios del hongo, previniendo así la infección de los tubérculos por alrededor de 3 a 5 días.
.
.
Bibliografía
Kumari P, Bishnoi SK, Chandra S (2021) Assessment of antibiosis potential of Bacillus sp. against the soil-borne fungal pathogen Sclerotium rolfsii Sacc. (Athelia rolfsii (Curzi) Tu & Kimbrough). Egypt J Biol Pest Control 31: 17. doi: 10.1186/s41938-020-00350-w
Matnork Supot, Thitla T, Imaiam N, Nalumpang S (2021) In vitro Evaluation of Fungicides and Wood Vinegar to Control Sclerotium rolfsii Causing Potato Sclerotium Rot Disease. Asian Journal of Plant Pathology 15: 14-22. Link
Song J, Qiu H, Meng X, et al. (2024) Risk assessment and molecular mechanism of Sclerotium rolfsii resistance to boscalid. Pesticide Biochemistry and Physiology: 105806. doi: 10.1016/j.pestbp.2024.105806
, , , (2022) Molecular detection and pathological investigations on southern blight disease caused by Sclerotium rolfsii on cabbage (Brassica oleracea var. capitata): A new record in India. Journal of Phytopathology 170: 363– 372. doi: 10.1111/jph.13085
Zhong J, Chen D, Zhu HJ, et al. (2016) Hypovirulence of Sclerotium rolfsii Caused by Associated RNA Mycovirus. Front. Microbiol. 7: 1798. doi: 10.3389/fmicb.2016.01798