.
Condición fitosanitaria: Presente
Grupo de cultivos: Oleaginosas
Especie hospedante: Maní (Arachis hypogaea L.)
Rango de hospedantes: no específico / amplio. Es un hongo polífago que tiene un amplio rango de hospedantes, tiene la capacidad de infectar aproximadamente a 100 familias, con más de 500 hospedantes.
Etiología: Hongo. Necrotrófico, con capacidad de supervivencia en el suelo.
Agente causal: Sclerotium rolfsii (Sacc.) West. (anamorfo) / Athelia rolfsii (teleomorfo)
Sclerotium rolfsii es la fase anamórfica del patógeno que se encuentra bajo el grupo Incertae sedis, ya que su clasificación es controvertida debido a que la etapa teliomórfica, es decir, la etapa sexual se observa raramente. El teleomorfo Athelia rolfsii (Curzi) C.C. Tu & Kimbr. es un basidiomycota, que se clasifica de la siguiente manera:
.
Taxonomía: Eukaryota > Fungi > Dikarya > Basidiomycota > Agaricomycotina > Agaricomycetes > Atheliales > Atheliaceae > Athelia
.
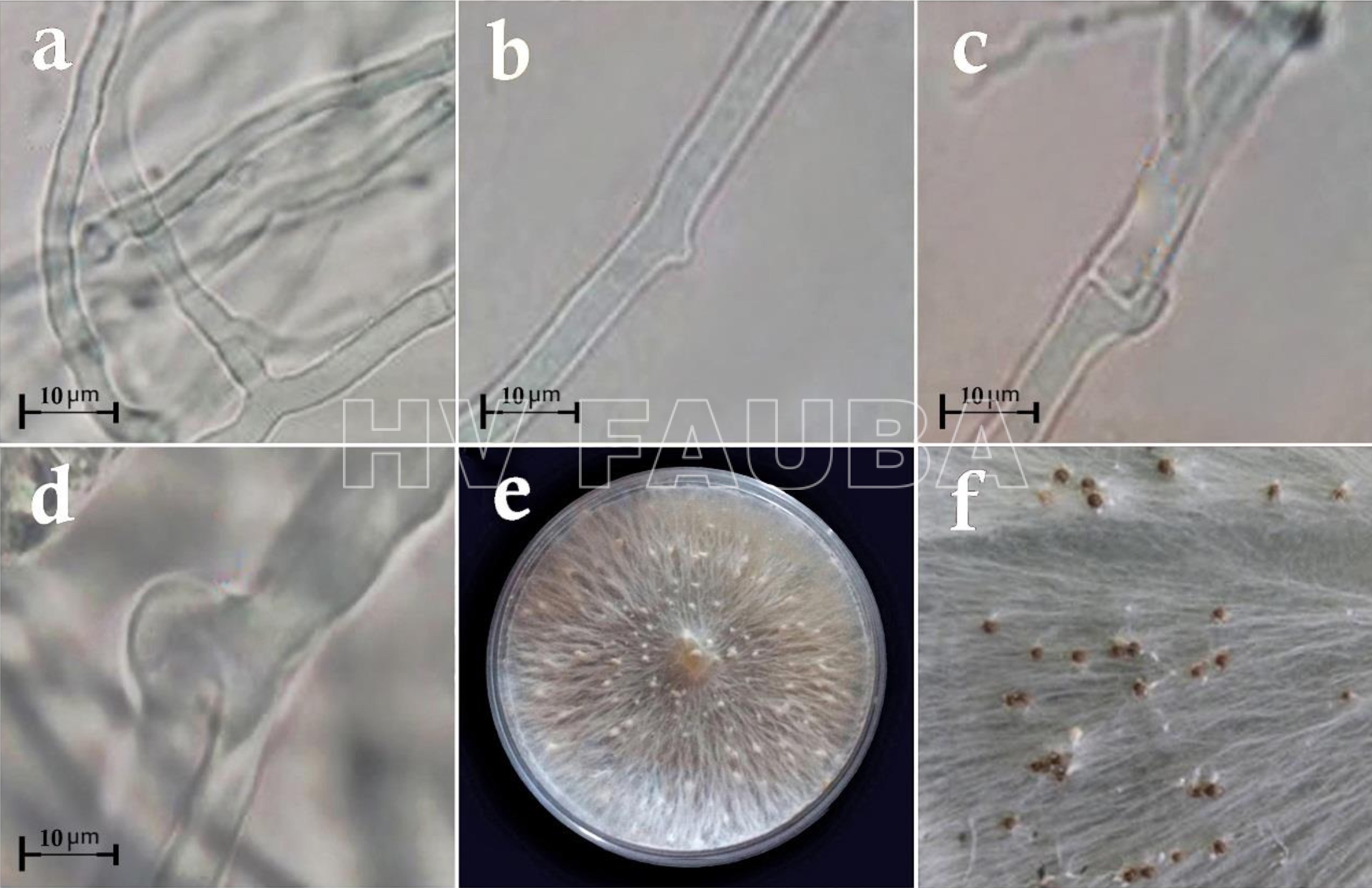
S. rolfsii no forma esporas ni estructuras fructíferas asexuales. El hongo forma esclerocios que comienzan a formarse como pequeños mechones de micelio blanco que forman esclerocios esféricos de 0,5 a 1,5 mm de diámetro. Los esclerocios se oscurecen a medida que maduran y se vuelven de color canela a marrón oscuro. Estos esclerocios permiten que el hongo sobreviva durante largos períodos en los restos culturales de plantas y el suelo.
Es común observar en el micelio la conexión de abrazadera (fíbula) (ver imagen a continuación). La fíbula, también llamada conexión en fíbula (unión en fíbula), en abrazadera o clamp (del inglés: clamp connection), es una estructura que se encuentra en muchas especies de basidiomicetos y que se produce entre dos células binucleadas adyacentes de una misma hifa. Esta estructura contribuye a que durante la mitosis de una célula con dos núcleos (A y B), las copias de ambos núcleos (A’ y B’) se mantengan en la nueva célula.
.
- Imágenes microscópicas de Sclerotium rolfsii: (a,b) micelio; (c, d) conexión de abrazadera (fíbula); (e) patrón de distribución del micelio en el medio PDA; (f) formación de esclerocios. Autor: Safari Motlagh et al., 2022
.
.
.
Antecedentes
S. rolfsii ataca muchos cultivos de grano (ej. maní, soja) y hortícolas (ej. papa, tomate, repollo) en regiones cálidas.
.
Daños y pérdidas
La enfermedad puede incurrir en pérdidas de rendimiento del 10 al 40%, especialmente en condiciones de riego (Bera et al., 2014; Dodia et al., 2019); pero puede alcanzar más del 80% en campos muy infestados (Akgul et al., 2011; Bera et al., 2014). En Argentina, desde mediados de la década de 1980 la enfermedad se empezó a observar con mayor frecuencia. Se registraron valores de incidencia de entre el 1 y el 25 % según los años y lotes analizados (Marinelli et al., 1998; March et al., 2005)
.
Sintomatología
S. rolfsii infecta principalmente los tallos, pero también ataca las hojas, las vainas y todas las partes de la planta, por lo que causa daños severos durante todas las etapas de crecimiento del cultivo (Cilliers et al. 2000; Ganesan et al. 2007). El hongo ataca principalmente la base de los tallos cerca de la línea del suelo, pero cualquier parte de la planta en contacto con el suelo puede resultar dañada. Las plantas infectadas generalmente mueren antes de la madurez. Las infecciones de clavijas y vainas son comunes y dan como resultado la pérdida de vainas en la cosecha. El síntoma inicial de una infección en la planta incluye lesiones de color marrón oscuro en el tallo en o justo debajo de la superficie del suelo, seguidas por el progresivo amarillamiento y marchitamiento de las hojas (Termorshuizen, 2007). Los primeros síntomas de la pudrición del tallo incluyen el marchitamiento o el amarillamiento de las ramas individuales o del tallo principal. A medida que la enfermedad progresa, las lesiones pueden extenderse a la corona de la planta y matarla. Los tallos y las coronas colonizados son de color marrón oscuro, quebradizos y triturados. Las clavijas marrones trituradas pueden pudrirse sin producir una vaina, o las clavijas pueden separarse de las vainas que ya se han formado, lo que hace que se desprendan. Se pueden formar lesiones distintas en las vainas durante las primeras etapas de la infección, pero las vainas posteriores se consumen por completo con una pudrición marrón seca. Las vainas podridas son delgadas y quebradizas y las semillas pueden estar manchadas, podridas o ausentes. Es decir, cuando los clavos son afectados, los frutos se desprenden durante el arrancado y quedan en el suelo, y si solo los frutos son invadidos se produce la podredumbre de los mismos, no presentando esas plantas síntomas en el follaje (March et al., 2005). El ácido oxálico producido por S. rolfsii causa una decoloración azul en la superficie de la semilla y afecta la calidad general de la semilla (Varshney et al., 2014). El desprendimiento y la pudrición de las vainas es una de las principales causas de la pérdida de rendimiento. Las poblaciones de S. rolfsii aumentan en los campos infestados de maní, a menos que se tomen medidas de control.
En la base de las plantas de maní y sobre el suelo se pueden observar folíolos desprendidos, micelio blanco y sobre el mismo los esclerocios producidos por el patógeno.
.
.
- Ramas de maní marchitas. Síntoma de la enfermedad.. Autor: Ing. Agr. Santiago Mortigliengo
- Micelio del hongo en la base del tallo de la planta. Signo de la enfermedad. Autor: Ing. Agr. Santiago Mortigliengo
- Esclerocios en las ramas de la planta y el suelo, y micelio del hongo en la planta. Estructura de resistencia y signo de la enfermedad. Autor: Ing. Agr. Santiago Mortigliengo
.
.
Manejo de la enfermedad
El manejo de la pudrición del tallo es bastante complejo, ya que el hongo forma esclerocios que pueden sobrevivir durante un período prolongado en el suelo, debido a la presencia de melanina en la membrana externa.
La base molecular de la resistencia a Sclerotium rolfsii en maní es muy poco conocida (Dodia et al., 2019; Bosamia et al., 2020). Se han identificado fuentes de resistencia (QTLs, Dodia et al., 2019).
.
- Autor: Bob Kemerait
.
.
.
Bibliografía
Abo-Zaid G, Abdelkhalek A, Matar S, et al. (2021) Application of Bio-Friendly Formulations of Chitinase-Producing Streptomyces cellulosae Actino 48 for Controlling Peanut Soil-Borne Diseases Caused by Sclerotium rolfsii. Journal of Fungi 7(3): 167. doi: 10.3390/jof7030167
Akgul DS, Ozgonen H, Erkilic A (2011) The effects of seed treatments with fungicides on stem rot caused by Sclerotium rolfsii sacc., in peanut. Pak J Bot 43(6): 2991–2996. Link
Aycock R (1966) Stem Rot and other Diseases Caused by Sclerotium Rolfsii or the Status of Rolfs’ Fungus after 70 Years; North Carolina State University: Raleigh, NC, USA.
Bera SK, Kasundra SV, Kamdar JH, et al. (2014) Variable response of interspecific breeding lines of groundnut to Sclerotium rolfsii infection under field and laboratory conditions. Electron J Plant Breed. 5: 22–29. Link
Bosamia TC, Dodia SM, Mishra GP, et al. (2020) Unraveling the mechanisms of resistance to Sclerotium rolfsii in peanut (Arachis hypogaea L.) using comparative RNA-Seq analysis of resistant and susceptible genotypes. PLoS ONE 15(8): e0236823. doi: 10.1371/journal.pone.0236823
Chet I (1975) Ultrastructural basis of sclerotial survival in soil. Microbiol. Ecol. 2: 194–200. doi: 10.1007/BF02010439
Cilliers AJ, Herselman L, Pretorius ZA (2000) Genetic Variability Within and Among Mycelial Compatibility Groups of Sclerotium rolfsii in South Africa. Phytopathology 90(9): 1026-31. doi: 10.1094/PHYTO.2000.90.9.1026
Dodia SM, Joshi B, Gangurde SS, et al. (2019) Genotyping-by-sequencing based genetic mapping reveals large number of epistatic interactions for stem rot resistance in groundnut. Theor Appl Genet 132: 1001–1016. doi: 10.1007/s00122-018-3255-7
Ganesan P, Gnanamanickam SS (1987) Biological control of Sclerotium rolfsii sacc. in peanut by inoculation with Pseudomonas fluorescens. Soil Biology and Biochemistry 19: 35-38. doi: 10.1016/0038-0717(87)90122-2
Ganesan S, Kuppusamy GR, Sekar R (2007) Integrated management of stem rot disease (Sclerotium rolfsii) of groundnut (Arachis hypogaea L.) using rhizobium and Trichoderma harzianum (ITCC-4572). Turk J Agric For 31(2): 103–108. Link
Karthikeyan V, Sankaralingam A, Nakkeeran S (2006) Management of groundnut root rot with biocontrol agents and organic amendments. Arch Phytopathology Plant Protect. 39: 215–223. doi: 10.1080/03235400500094225
Kumari P, Bishnoi SK, Chandra S (2021) Assessment of antibiosis potential of Bacillus sp. against the soil-borne fungal pathogen Sclerotium rolfsii Sacc. (Athelia rolfsii (Curzi) Tu & Kimbrough). Egypt J Biol Pest Control 31: 17. doi: 10.1186/s41938-020-00350-w
March GJ, Rago A, Marinelli A (2005) Marchitamiento-Hongo blanco. En: March G, Marinelli A (eds.) Enfermedades del maní en Argentina. Biglia impresores. Córdoba. p. 59-66.
Marinelli A, March GJ, Rago A, Giuggia (1998) Assessment of crop loss in peanut caused by Sclerotinia sclerotiorum, S. minor, and Sclerotium rolfsii in Argentina. International Journal of Pest Management 44: 251-254. doi: 10.1080/096708798228185
Mehan Vk, Mayee CD, Mcdonald D (1994) Management of Sclerotium rolfsii-caused stem and pod rots of groundnut-a critical review. International Journal of Pest Management 40(4): 313-320. Link
Safari Motlagh MR, Farokhzad M, Kaviani B, Kulus D (2022) Endophytic Fungi as Potential Biocontrol Agents against Sclerotium rolfsii Sacc.—The Causal Agent of Peanut White Stem Rot Disease. Cells 11(17): 2643. doi: 10.3390/cells11172643
Shokes FM, Rozalski K, Gorbet DW, et al. (1996) Techniques for Inoculation of Peanut with Sclerotium rolfsii in the Greenhouse and Field. Peanut Science 23: 124-128. Link
Singh SP, Gaur R (2016) Evaluation of antagonistic and plant growth promoting activities of chitinolytic endophytic actinomycetes associated with medicinal plants against Sclerotium rolfsii in chickpea. J. Appl. Microb. 121: 506–518. doi: 10.1111/jam.13176
Song J, Qiu H, Meng X, et al. (2024) Risk assessment and molecular mechanism of Sclerotium rolfsii resistance to boscalid. Pesticide Biochemistry and Physiology: 105806. doi: 10.1016/j.pestbp.2024.105806
, , , (2022) Molecular detection and pathological investigations on southern blight disease caused by Sclerotium rolfsii on cabbage (Brassica oleracea var. capitata): A new record in India. Journal of Phytopathology 170: 363– 372. doi: 10.1111/jph.13085
Termorshuizen AJ (2007) Fungal and Fungus-Like Pathogens of Potato. In: Vreugdenhil D, Bradshaw J, Gebhardt C, et al. (Eds.), Potato Biology and Biotechnology. Elsevier, Amsterdam, pp 643–665. doi: 10.1016/b978-044451018-1/50071-3
Varshney RK, Pandey MK, Janila P, et al. (2014) Marker-assisted introgression of a QTL region to improve rust resistance in three elite and popular varieties of peanut (Arachis hypogaea L.). Theor Appl Genet 127: 1771–1781. doi: 10.1007/s00122-014-2338-3
Zhong J, Chen D, Zhu HJ, et al. (2016) Hypovirulence of Sclerotium rolfsii Caused by Associated RNA Mycovirus. Front. Microbiol. 7: 1798. doi: 10.3389/fmicb.2016.01798