.
Condición fitosanitaria: Presente
Grupo de cultivos: Cereales
Rango de hospedantes: los miembros del género Claviceps parasitan más de 600 plantas monocotiledóneas (Bové, 1970).
Especie hospedante: Sorgo (Sorghum bicolor (L.) Moench)
Epidemiología: oligocíclica, subaguda.
Etiología: Hongo. Biotrófico. El hongo se comporta como un verdadero biótrofo en planta, aunque se puede cultivar fácilmente en cultivo axénico.
Agente causal:
Claviceps sorghi B.G.P. Kulk., Seshadri & Hegde, 1976
Claviceps africana Freder., Mantle & De Milliano, 1991
Claviceps sorghicola Tsukib., Shiman. & T. Uematsu, 1999
El estado asexual de las dos primeras especies de Claviceps es Sphacelia sorghi.
Taxonomía: Fungi > Dikarya > Ascomycota > Pezizomycotina > Sordariomycetes > Hypocreales > Clavicipitaceae > Claviceps
.Sphacelia es la etapa conidial del cornezuelo (Claviceps). Anteriormente era el nombre del género, ahora conocido como la etapa o forma conidial de Claviceps. La forma imperfecta es más frecuente en la naturaleza y esta asociada a un liquido azucarado liberado de las flores infectadas, el micelio en el interior del ovario produce conidios sobre conidioforos. También han sido descritos tres tipos de esporas en Sphacelia sorghi que son: macroconidios, microconidios, y conidios secundarios.
El patógeno produce esfacelia, macroconidios (producidos dentro de melaza), conidios secundarios (producidos a partir de macroconidios) y esclerocios. En Argentina no se ha observado la producción de esclerocios. El patógeno sobrevive en la melaza seca en la superficie del suelo, en residuos de plantas y como esfacelia y esclerocios en lotes de semillas.
.
Antecedentes
El ergot del sorgo se reportó por primera vez en 1915, en estado de Madras en la India. Es causado por el hongo Claviceps africana en algunas partes del sudeste de África (Anónimo, 1996) y por Claviceps sorghi en la India (Rodriguez, 1997).
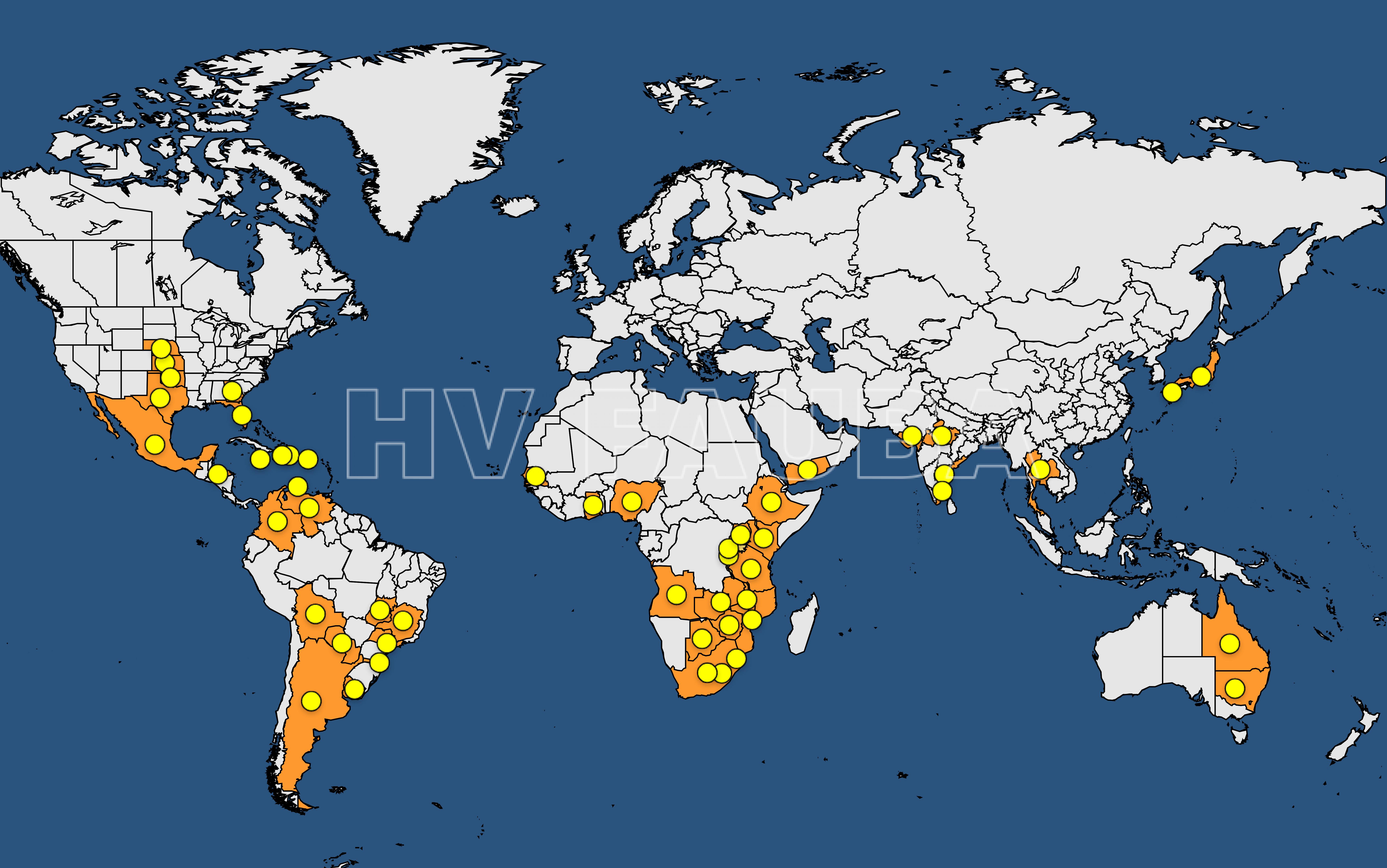
A mediados de 1995, se informó de una epidemia generalizada y económicamente importante de Claviceps africana (enfermedad azucarada del sorgo o cornezuelo del centeno) en campos comerciales de forraje y campos de producción de híbridos F1 en Brasil. Este fue el primer informe de algún cornezuelo de sorgo fuera de Asia y África. Antes de 1995, C. africana se encontraba principalmente en África. Otra especie de Claviceps, C. sorghi, actualmente se limita al subcontinente indio (figura 1). Una tercera Claviceps spp no descrita. ocurre solo en Japón. Hasta que se clasificó como una especie distinta en 1991, C. africana se consideraba sinónimo de C. sorghi.
Ocurre regularmente (p. ej., Texas) o con poca frecuencia (p. ej., Nebraska) en toda la región productora de sorgo de los EE. UU. El ergot se observó en Brasil durante la campaña agrícola de 1995. Luego la enfermedad se extendió y se reportó en todas las regiones productoras de sorgo en Brasil (Rodríguez y Frederickson, 1997).
C. africana es la especie de mayor distribución mundial, se ha reportado en África, América, Asia y Oceanía (CABI, 2018). En Argentina, esta especie fue identificada en 1997 (Delhey, 2017). En la provincia de Entre Ríos fue reportada en 1998 (Formento, 2004).
.
- Distribución mundial del ergot del srogo. Fuente: https://gd.eppo.int/taxon/CLAVAF/distribution
.
Sintomatología
El síntoma inicial es una masa esfacelial blanca que forza a las glumas a separarse, al siguiente día se observan exudados incoloros y no viscosos (ligamaza) que se vuelven más opacos a medida que las conidias son liberados de las fructificaciones esfaceliales. Posteriormente la superficie de la ligamaza se torna blanquecina (Ramirez Orozco, 2001).
Estas especies de Claviceps solo atacan los ovarios no fertilizados. Unos pocos o todos los ovarios dentro de una panícula se infectan individualmente. Hay dos signos muy evidentes de la enfermedad en el campo. La más temprana es la melaza que rezuma de los cogollos infectados. La melaza es un fluido dulce, pegajoso, delgado o viscoso que contiene los conidios esfaceliares. Las gotas de melaza recién formadas son incoloras y transparentes, pero se vuelven progresivamente opacas. Con el tiempo, la melaza puede volverse uniformemente de color marrón amarillento a rosa o superficialmente blanca. Puede permanecer como gotitas intactas o puede ser tan abundante que gotea sobre cogollos, semillas, hojas y el suelo no infectados debajo de la panícula. Cuando la humedad relativa es elevada, las gotitas de melaza desarrollan una cubierta blanca opaca similar a una escoria a medida que se producen conidios secundarios. Las panículas así infectadas son evidentes, incluso desde la distancia, particularmente si la melaza se ha esparcido sobre la panícula. Las panículas infectadas también pueden destacarse por el crecimiento de Epicoccum Link, 1816 (syn Cerebella sp. Ces., 1851), un hongo saprofito que forma un crecimiento negro que cubre las flores infectadas. El segundo signo del cornezuelo es la presencia de esfacelos o esclerocios fúngicos entre las glumas de los cogollos infectados. En las infecciones por C. africana, se observa un cojín compacto de micelio (sphacelium) de color blanco a gris en un examen minucioso, generalmente un día antes de que se produzca la melaza. Los esclerocios de textura dura que se desarrollan más tarde a partir de los esfacelios rara vez sobresalen más de unos pocos milímetros más allá de las glumas. Por el contrario, los esclerocios cilíndricos de C. sorghi pueden sobresalir hasta 1,5 cm más allá de las glumas.
.
- Autora: Dra. Norma Angela Formento
- Autora: Dra. Norma Angela Formento
.
Toxicología
A diferencia de otras especies de Claviceps que producen sustancias tóxicas (los alcaloides ergotamina y agroclavina,), en sorgo C. africana produce la dihidroergosina. En estudios realizados en ganado bovino bajo pastoreo no se encontraron efectos negativos cuando la concentración de esclerocios no superó el 0.3%, que es el límite establecido por Australia para el empleo de sorgo enfermo en alimentación animal. Estudios preliminares no demostraron toxicidad en ganado bovino, bajo pastoreo o alimentado con silo de grano húmedo de sorgo afectado (Giorda, 2001 ). En cerdos y aves alimentados con sorgos con 5% de esclerocios si se observaron síntomas de toxicidad (Odvody et al., 1998).
.
.
Ciclo de la enfermedad y epidemiología
Las posibles fuentes de inóculo incluyen depósitos de melaza, esfacelia o esclerocios (todas fuentes de macroconidios) o tejido esclerocial (una fuente de ascosporas después de la germinación). La infección puede iniciarse tanto por ascosporas provenientes de esclerocios germinados y dispersados por el viento o por conidios liberadas de la melaza producida en las flores. La planta es vulnerable a la infección desde el momento de emergencia de la panícula hasta la fertilización del ovario (Frederickson et al., 1989, Mughogho, 1991). Las esporas germinan sobre el estigma produciendo tubos germinativos que penetran a la papila estigmática (la ruta para infectar al ovario es similar a la que sigue el polen durante la fertilización) (Frederickson y Mantle, 1988).
De acuerdo con las investigaciones de Frederickson y Odvody (2003) en Zimbabwe, los macroconidios no sobreviven más de unas pocas semanas fuera de temporada en depósitos delgados de melaza. Al comienzo de la temporada de lluvias, los macroconidios aún conservan una buena viabilidad dentro de la esfacelia. Sin embargo, la humedad y las altas temperaturas de la estación lluviosa no favorecen la supervivencia de los macroconidios, y la viabilidad es muy baja cuando comienza la estación lluviosa. Estos investigadores supervisaron de cerca las fuentes con inóculo viable para determinar cómo y cuándo se generó el inóculo infeccioso en condiciones naturales. Llegaron a la conclusión de que los sorgos silvestres y otros hospedantes alternativos pueden desempeñar un papel en la perenneización de C. africana.
La infección ocurre en forma específica a través de la flor del sorgo, la cual ocurre únicamente si los conidios se depositan sobre el estigma de un ovario no fecundado. Cualquier factor que reduzca la viabilidad del polen y/o retrase la polinización y la posterior fecundación, favorece la infección mientras exista inóculo viable. La enfermedad es de mayor importancia en lotes de producción de semilla híbrida, donde las flores androestériles permanecen viables y susceptibles antes de ser fecundadas por el polen. El estrés por frío es el factor más predisponente ya que temperaturas nocturnas bajas en el período de 3-4 semanas antes de floración reducen la viabilidad del polen y la formación de granos, aumentando la susceptibilidad del hospedante. Las condiciones óptimas para la infección y el desarrollo de la enfermedad son temperaturas moderadas y alta humedad relativa durante la antesis, con un prolongado período de mojado foliar (Bandyopadhyay et al., 1998; Panizzi et al., 2005).
.
Manejo Integrado
* Utilizar semillas libres de esclerocios
* Aplicar fungicidas curasemillas
* Realizar siembras tempranas (octubre-noviembre) o si son de “segunda” emplear híbridos precoces.
.
.
.
.
Bibliografía
Agrios GN (2005) Plant Pathology. 5th ed. Elsevier–Academic Press, Boston.
Bandyopadhyay R, Frederickson DE, McLaren NW, et al. (1998) Ergot: a new disease threat to Sorghum in the Americas and Australia. Plant Disease 82(4): 356-367. doi: 10.1094/PDIS.1998.82.4.356
CABI (2009) Claviceps africana (ergot). Invasive Species Compendium. CABI. doi: 10.1079/cabicompendium.13787
Delhey R (2017) Enfermedades de Sorghum bicolor (L.) Moench subsp. bicolor (sorgos). En: Atlas Fitopatológico Argentino. Vol. 4, N° 4. Eds Nome SF, Docampo DM, Conci LR. Córdoba, Argentina. Link
Formento AN (2004) Problemas asociados a las panojas de sorgo. Sitio Argentino de Producción Animal. Link
Formento AN, López R, Díaz MG, Kuttel W (2011) Presencia del mildiu del sorgo (Peronosclerospora sorghi) en Entre Ríos. Revista Técnica Siembra Directa Maíz. AAPRESID. p. 81-85.
Formento AN, Schutt L, López R, et al. (2012) Efecto de la fecha de siembra y el genotipo sobre la incidencia del mildiu del sorgo (Peronosclerospora sorghi). Segundo Simposio Nacional de Sorgo, Pergamino.
Frederickson DE, Mantle WAJ (1988) The path of infection of srghum by Claviceps sorghi Physiol. Mol Plant Pathology 33: 221-234.
Frederickson DE, Mantle GP, De Milliano AJW (1989) Secondary conidiation of Sphacelia sorghi on sorghum, a novel factor in the epidemiology of disease. Mycological Research 93(4): 497-502.
Frederickson DE, Mantle GP, De Milliano AJW (1991) Claviceps africana sp. Nov; the distinctive ergot pathogen of sorghum in Africana .Mycological Research 95(9): 828-831.
Frederickson DE, Mantle GP, De Milliano AJW (1993) Windborne spread of ergot disease (Claviceps africana) in sorghum A-lines zimbabwe. Plant Pathology 42: 368-377.
Frederickson DE, Odvody GN (2003) Survival of Inoculum of Claviceps africana in Zimbabwe: Potential Sources of Initial Inoculum. In Sorghum and Millets Diseases, J.F. Leslie (Ed.). doi: 10.1002/9780470384923.ch13
Frederickson DE, Odvody GN (2003) Inhibition of germination of sphacelial conidia of Claviceps africana following treatment of seed–sphacelia admixtures with captan. Crop Protection 22: 95-98. doi: 10.1016/S0261-2194(02)00116-3
Frutell MC, Webster OJ (1996) Host range and epidemiology of sorghum ergot organism. Plant Dis. Rep. 50: 828-831.
Giorda L (2001) Ergot del Sorgo. INTA-E.E.A Manfredi.
Mantle PG (1986) Inhibition of lactatition in mice fellowing with ergot Sclerotina (Claviceps fusiformis Loveless) and alkaloides componet. Proc. Royal Soc. London ser. B. 170: 423.
Mc Laren NW (1992) Quantifyting Resistence of genotipes to the Sugary Disease Phatogen (Claviceps africana). Plan Disease 76(10): 986-988.
Melofe TL (1975) Ocurrence of ergot on sorghum in Bostswana. Plant disease Reporter (USA) 59 (9): 751-753.
Miedaner T, Geiger HH (2015) Biology, Genetics, and Management of Ergot (Claviceps spp.) in Rye, Sorghum, and Pearl Millet. Toxins 7(3): 659-678. doi: 10.3390/toxins7030659
Mughogho KL (1991) Ergot. En Frederickson R. A (de) compendium of sorghum disease. ASP Press. USA.
Odvody G, Bandyopadhyay R, Frederiksen RA, et al. (1998) Sorghum Ergot Goes Global in Less Than Three Years. doi: 10.1094/APSFeature-1998-06
Odvody GN, Montes N, Frederickson DE, Narro-Sánchez J (2003) Detection of Sclerotia of Claviceps africana in the Western Hemisphere. In Sorghum and Millets Diseases, Leslie JF (Ed). doi: 10.1002/9780470384923.ch24
Panizzi RC, Fernandes NG e Camargo M (2005) Doenças do sorgo (Sorghum bicolor). En: Kimati H, Amorin L, Rezende JAM, et al. (Eds). Manual de Fitopatologia. Vol. 2: doenças das plantas cultivadas. Editora Agronômica Ceres Ltda. São Paulo. Cap. 66. p. 597-606.
Patil BG, Seshadri VS, Hegde RK (1976) The perfect stage of Sphacelia sorghi; Mc Rae. Mysonre y Agric. Sci. 10: 286-289.
Ramirez Orozco M (2001) Determinación de la Incidencia y Severidad del Ergot de Sorgo (Sphacelia sorghi) en el Ejido de La Tepuza, Municipio de Numaran, Michoacán. Tesis de grado, Universidad Autonoma Agraria “Antonio Narro”. Link
Stange P, Seidl S, Karl T, et al. (2023) Evaluation of Trichoderma isolates as biocontrol measure against Claviceps purpurea. Eur J Plant Pathol. doi: 10.1007/s10658-023-02716-w
Sundaram NV (1978) Sorghum Ergot. Procedings of international Workshop on sorghum disease. Hyderabad, India 11-15 December 1987 ICRISAT.
Tegegne G, Bandyopadhyay E, Mulato T, Kebede (1994) Screening for ergot Resistence in sorghum. Plant Disease 78(9): 873-875.
Toledo JJA (1998) Ergot del sorgo. Monografía UAAAN. Pág. 20-22
Velazquez PD (2019) Enfermedades del sorgo en el centro oeste de entre ríos. Boletín de la Asociación Argentina de Fitopatólogos. N°4. ISSN: 2618-1932. Link
Velazquez PD, Formento AN (2014) Ergot o enfermedad azucarada del sorgo en Entre Ríos. Ciclo agrícola 2013/14. Link
Velazquez PD (2020) «Ergot» en sorgo, ¿debemos preocuparnos cuando alimentamos al ganado? INTA. Link