.
Condición fitosanitaria: Presente
Grupo de cultivos: Frutales
Subgrupo: Cítricos
Especie hospedante: Limón (Citrus limonum), Mandarina (Citrus nobilis), Naranjo (Citrus sinensis) y Pomelo (Citrus paradisi)
Rango de hospedantes: Penicillium digitatum (moho verde) infecta exclusivamente los frutos cítricos (Marcet-Houben et al., 2012), mientras que P. expansum (moho azul) puede infectar y desarrollar pudrición en un amplio rango de cultivos frutales, entre los que se encuentran las manzanas (Buron-Moles et al. 2015), las peras (Paster et al. . 2009), durazneros (Yang et al. 2011), avellanos (Yang et al. 2014) y otros (Judet-Correia et al. 2010; Cao et al. 2012). Aunque se considera un patógeno de poscosecha importante, Penicillium digitatum se describió previamente con un rango de hospedantes limitado, con capacidad de infectar frutos pertenecientes a la familia Rutaceae exclusivamente. Sin embargo, evidencia creciente muestra que el P. digitatum también es un patógeno oportunista de frutas de pepita (manzana y pera) y frutas de carozo (nectarina y ciruela), que antes se pensaba que no eran hospedantes de P. digitatum. El genoma de las especies de Penicillium parece ser muy dinámico, con variaciones específicas de linaje en el tamaño del genoma que representan hasta el 20% del genoma. Curiosamente, una relación entre el tamaño del genoma o proteoma y el rango de hospedantes parece estar presente entre las tres especies de Penicillium que son patógenos de la fruta. P. digitatum, que muestra el rango de hospedantes más restringido, tiene el proteoma más pequeño, mientras que P. expansum, que puede infectar a muchos otros hospedantes además de la fruta de pepita, tiene el proteoma más grande. P. italicum se encuentra tanto en tamaño de genoma como en rango de hospedantes entre las otras dos especies (Rosa Ballester et al., 2015).
Etiología: Hongo. Necrotrófico
Agente causal: Penicillium digitatum (Pers.:Fr.) Sacc., Fung. Ital.: 894. 1881.
= Eupenicillium F. Ludw., Lehrbuch der Niederen Kryptogamen: 263. 1892, fide Houbraken & Samson 2011. [MB1933]. teleomorphic synonym. (Visagie et al., 2014)
.
La especie Penicillium digitatum es única en su combinación de características. Las estructuras de conidióforos y conidios son irregulares y excepcionalmente grandes para Penicillium, generalmente biverticiladas en lugar de terverticiladas y los conidios son de color verde oliva. Las conidios son grandes, de elipsoidales a cilíndricos (Frisvad y Samson, 2004). Los datos de los genes β-tubulina (Samson et al. 2004) y RPB2 muestran que esta sección está situada en el subgénero Penicillium (Houbraken y Samson, 2011).
.
- Pudrición del moho verde en frutos de naranja infectados con Penicillium digitatum. (a) Naranjada con síntomas de moho verde; (b) aspecto típico de P. digitatum creciendo en placas PDA; (c) Conidiforos de P. digitatum con conidios terminales en cadenas observados por microscopía óptica de campo claro; (d) P. digitatum con fluorescencia después de teñir con CFW. Autor: Sánchez, 2021.
- Autor: Nick Talbot
.
Taxonomía: Fungi > Ascomycota > Pezizomycotina > Eurotiomycetes > Eurotiales > Trichocomaceae > Penicillium
.
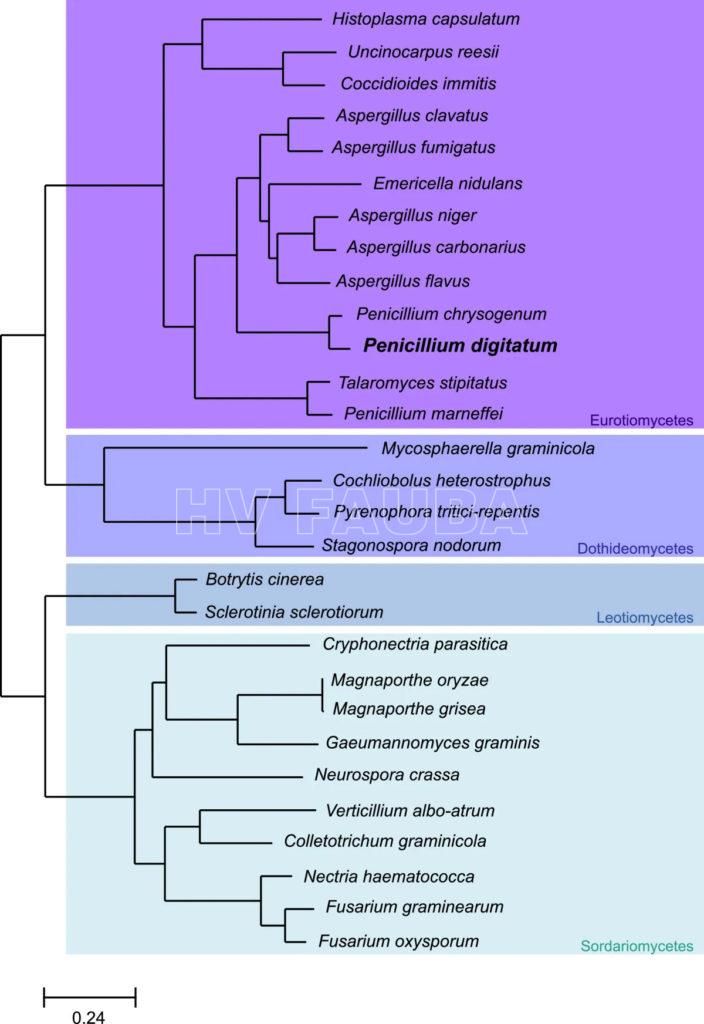
- Árbol de especies que muestra la posición filogenética de Penicillium digitatum en otras 28 especies de Pezizomycotina (Marcet-Houben et al., 2012).
.
.
Recientemente se demostró la capacidad sexual del hongo Penicillium roqueforti, utilizado como iniciador para la producción de queso azul (Ropars et al., 2012). Este hallazgo se basó, en parte, en la evidencia de genes de tipo de apareamiento funcional (MAT) que están involucrados en la compatibilidad sexual fúngica, y en la presencia en el genoma secuenciado de la mayoría de los genes importantes que se sabe que están involucrados en la meiosis. Penicillium chrysogenum es de gran importancia médica e histórica como fuente industrial original y actual del antibiótico penicilina. La especie se consideró asexual durante más de 100 años a pesar de los esfuerzos concertados para inducir la reproducción sexual. Sin embargo, Bohm et al. (2013) finalmente demostraron la reproducción sexual en P. chrysogenum.
Antes de 2013, cuando entró en vigor el cambio de nomenclatura de «un hongo, un nombre», se utilizó Penicillium como género para anamorfos (formas clonales) de hongos y Talaromyces para los teleomorfos (formas sexuales) de hongos. Sin embargo, después de 2013, los hongos se reclasificaron en función de su relación genética entre sí y ahora los géneros Penicillium y Talaromyces contienen algunas especies capaces solo de reproducción clonal y otras que pueden reproducirse sexualmente. Otras especies de Penicillium pueden formar cleistotecios con ascosporas.
.
.
.
Antecedentes e importancia económica
El moho verde es la principal enfermedad de poscosecha de los cítricos. En inglés recibe el nombre de green mold. Los hongos fitopatógenos más dañinos de las naranjas son Penicillium digitatum, que causa la enfermedad del moho verde, responsable de aproximadamente el 90% de las pérdidas poscosecha (Costa et al., 2019; Papoutsis et al., 2019), y Penicillium italicum Wehmer, el agente causante de la enfermedad del moho azul. Esta última enfermedad se desarrolla más lentamente, sin embargo, presenta mayor resistencia al frío y a la escasa disponibilidad de agua, extendiendo y contaminando con facilidad un mayor número de naranjas sanas. La presencia de heridas en la superficie del fruto es fundamental para la infección por estos hongos.
.
Síntomas
Este hongo afecta a todas las variedades de cítricos, principalmente a naranjas y mandarinas provocando pudriciones en los frutos. Estos quedan recubiertos de micelio blanco con una gran cantidad de esporas que le dan una coloración verde.
En los tejidos enfermos aparecen manchas húmedas y ligeras que con el paso del tiempo envuelven las vesículas de jugo.
.
.
.
.
Condiciones predisponentes
Su ocurrencia depende de las condiciones climáticas y de la forma de manipulación de los frutos desde la cosecha. Con temperaturas favorables, en el transcurso de dos días las lesiones pueden alcanzar un tamaño de 4 – 5 cm y llegar a las vesículas de jugo. La temperatura óptima para el desarrollo del hongo es de 24ºC. A partir de los 30ºC, comienza a ser más lento su desarrollo. Se detiene su crecimiento cuando la temperatura supera los 37ºC o cuando las temperaturas son inferiores a 5ºC.
.
- Autor: Susana C. Gonçalves, The Centre for Functional Ecology, Faculty of Sciences and Technology of the University of Coimbra
.
.
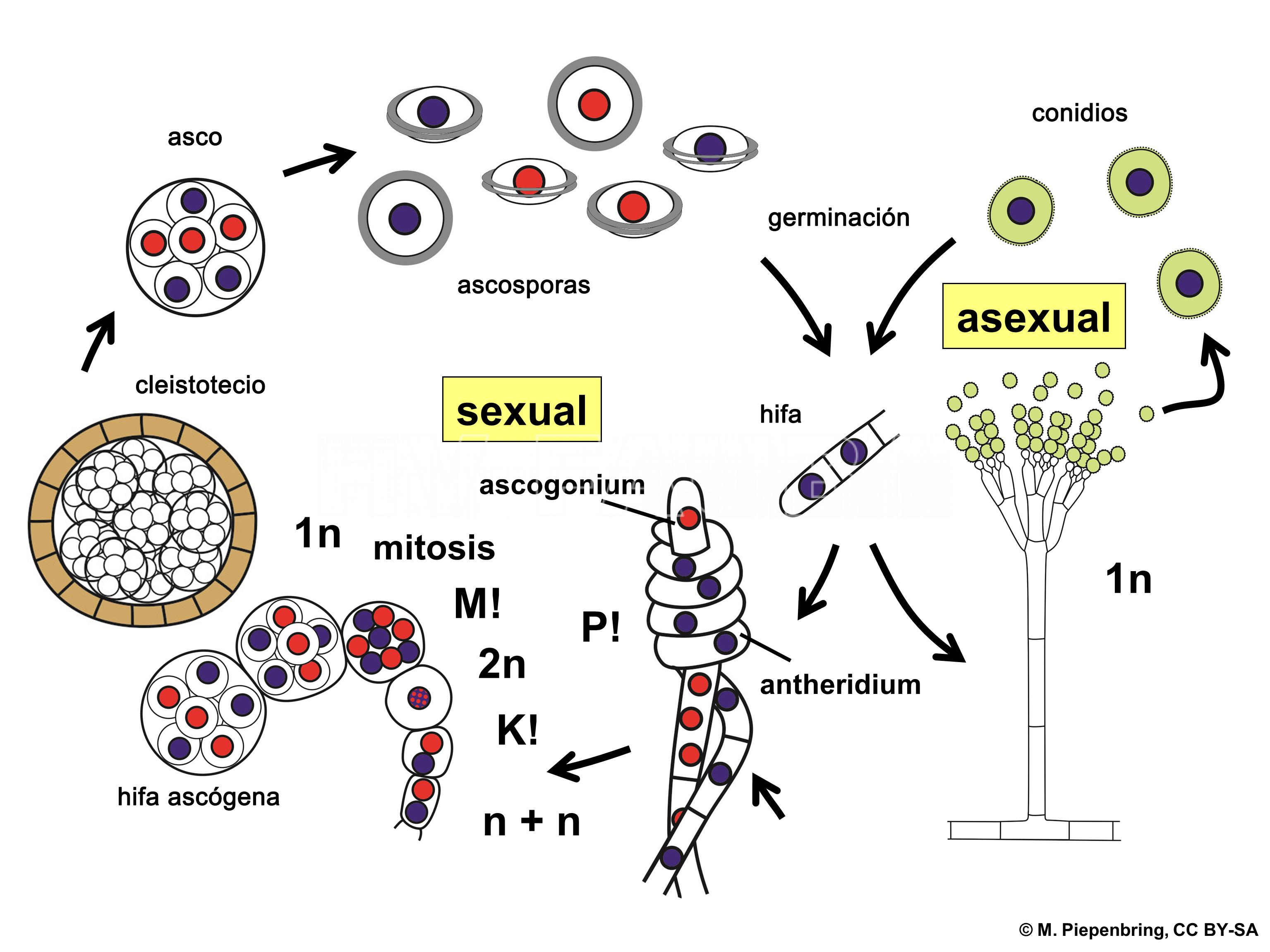
Ciclo de vida del patógeno
- Representación esquemática del ciclo de vida de Penicillium spp. P! = plasmogamia; K! = cariogamia; M! = meiosis; 2n = células diploides; 1n = células haploides; n + n = células dicarióticas.
.
.
Ciclo de la enfermedad
Penicillium digitatum sobrevive en el monte frutal de una estación a otra como conidios. La infección puede ocurrir durante la maduración del fruto, el transporte, el almacenamiento y su comercialización mediante heridas producidas por el roce, fricción o golpes. Estos factores también se asocian a la diseminación de las esporas.
Su gran capacidad de esporulación lleva a que se encuentren esporas en el aire de los campos, los centros de comercialización y hasta los hogares de los consumidores. La infección y el ciclo de esporulación, se puede repetir durante el ciclo de cultivo.
.
.
Manejo de la enfermedad
* Aplicación de fungicida
.
.
- Masas de esporas (conidios) secas de Penicillium digitatum.
- 01 Penicillium spp
- 02 Penicillium spp
- 01 Moho verde (Penicillium spp) en naranja. Autor: Ing. Francisco Sautua
- 02 Moho verde (Penicillium spp) en naranja. Autor: Ing. Francisco Sautua
- 03 Moho verde (Penicillium spp) en naranja. Autor: Ing. Francisco Sautua
- 04 Moho verde (Penicillium spp) en naranja. Autor: Ing. Francisco Sautua
- 05 Moho verde (Penicillium spp) en naranja. Autor: Ing. Francisco Sautua
- 06 Moho verde (Penicillium spp) en naranja. Autor: Ing. Francisco Sautua
- 07 Moho verde (Penicillium spp) en naranja. Autor: Ing. Francisco Sautua
- 08 Moho verde (Penicillium spp) en naranja. Autor: Ing. Francisco Sautua
- 09 Moho verde (Penicillium spp) en naranja. Autor: Ing. Francisco Sautua
- 10 Moho verde (Penicillium spp) en naranja. Autor: Ing. Francisco Sautua
.
.
.
Bibliografía
Ballester AR, Marcet-Houben M, Levin E, et al. (2015) Genome, Transcriptome, and Functional Analyses of Penicillium expansum Provide New Insights Into Secondary Metabolism and Pathogenicity. Mol Plant Microbe Interact. 28(3): 232-48. doi: 10.1094/MPMI-09-14-0261-FI
Benato EA, Belletti TC, Terao D, Franco DAS (2018) Óleos essenciais e tratamento térmico no controle pós-colheita de bolor verde em laranja. Summa Phytopathologica 44(1): 65-71. doi: 10.1590/0100-5405/175659
Böhm J, Hoff B, O’Gorman CM, et al. (2013) Sexual reproduction and mating-type-mediated strain development in the penicillin-producing fungus Penicillium chrysogenum. Proc Natl Acad Sci U S A. 110(4): 1476-1481. doi: 10.1073/pnas.1217943110
Cabedo N, Pilar López-Gresa M, Primo J, Ciavatta ML, González-Mas MC (2007) Isolation and Structural Elucidation of Eight New Related Analogues of the Mycotoxin (−)-Botryodiplodin from Penicillium coalescens. Journal of Agricultural and Food Chemistry 55(17): 6977–6983. doi: 10.1021/jf071568v
Cheng Y, Lin Y, Cao H, Li Z (2020) Citrus Postharvest Green Mold: Recent Advances in Fungal Pathogenicity and Fruit Resistance. Microorganisms 8(3): 449. doi: 10.3390/microorganisms8030449
Costa JH, Bazioli JM, de Moraes Pontes JG, Fill TP (2019) Penicillium digitatum infection mechanisms in citrus: What do we know so far? Fungal Biol. 123(8): 584-593. doi: 10.1016/j.funbio.2019.05.004
Costa JH, Wassano CI, Angolini CFF, Scherlach K, Hertweck C, Fill TP (2019) Antifungal potential of secondary metabolites involved in the interaction between citrus pathogens. Sci. Rep. 9: 18647. doi: 10.1038/s41598-019-55204-9
de Ramón-Carbonell M, López-Pérez M, González-Candelas L, et al. (2019) PdMFS1 Transporter Contributes to Penicilliun digitatum Fungicide Resistance and Fungal Virulence during Citrus Fruit Infection. Journal of Fungi. 5(4): 100. doi: 10.3390/jof5040100
Droby S, Eick A, Macarisin D, Cohen L, Rafael G, Stange R, McColum G, Dudai N, Nasser A, Wisniewski M, Shapira R (2008) Role of citrus volatiles in host recognition, germination and growth of Penicillium digitatum and Penicillium italicum. Postharvest Biology and Technology 49: 386-396. doi: 10.1016/j.postharvbio.2008.01.016
Farias MF et al. (2019) Control del moho verde (Penicillium digitatum) en frutos de naranja con mezcla de fungicidas y aceite esencial de limón. IX Congreso Argentino de Citricultura. Link
Gardner PD, Eckert JW, Baritelle JL, Bancroft MN (1986) Management strategies for control of Penicillium decay in lemon packinghouses: economic benefits. Crop Protection 5: 26-32. doi: 10.1016/0261-2194(86)90035-9
Houbraken J, Samson RA (2011) Phylogeny of Penicillium and the segregation of Trichocomaceae into three families. Stud Mycol. 70(1): 1-51. doi: 10.3114/sim.2011.70.01
Iqbal Z, Singh Z, Khangura R, et al. (2012) Management of citrus blue and green moulds through application of organic elicitors. Australasian Plant Pathol. 41: 69–77. doi: 10.1007/s13313-011-0091-5
Julca I, Droby S, Sela N, et al. (2016) Contrasting Genomic Diversity in Two Closely Related Postharvest Pathogens: Penicillium digitatum and Penicillium expansum. Genome Biology and Evolution 8(1): 218–227. doi: 10.1093/gbe/evv252
Kanashiro AM, Akiyama DY, Kupper KC and Fill TP (2020) Penicillium italicum: An Underexplored Postharvest Pathogen. Front. Microbiol. 11: 606852. doi: 10.3389/fmicb.2020.606852
Long CA, Wu Z, Deng BX (2005) Biological control of Penicillium italicum of Citrus and Botrytis cinerea of Grape by Strain 34–9 of Kloeckera apiculata. Eur Food Res Technol 221: 197–201. doi: 10.1007/s00217-005-1199-z
López-Pérez M, Ballester AR, González-Candelas L (2015) Identification and functional analysis of Penicillium digitatum genes putatively involved in virulence towards citrus fruit. Molecular Plant Pathology 16(3): 262-275. doi: 10.1111/mpp.12179
Louw JP, Korsten L (2015) Pathogenicity and Host Susceptibility of Penicillium spp. on Citrus. Plant Disease 99(1): 21-30. doi: 10.1094/PDIS-02-14-0122-RE
Marcet-Houben M, Ballester A, de la Fuente B, et al. (2012) Genome sequence of the necrotrophic fungus Penicillium digitatum, the main postharvest pathogen of citrus. BMC Genomics 13: 646. doi: 10.1186/1471-2164-13-646
Papoutsis K, Mathioudakis MM, Hasperué JH, Ziogas V (2019) Non-chemical treatments for preventing the postharvest fungal rotting of citrus caused by Penicillium digitatum (Green Mold) and Penicillium italicum (Blue Mold). Trends Food Sci. Technol. 86: 479–491. doi: 10.1016/j.tifs.2019.02.053
Ropars J, Dupont J, Fontanillas E, et al. (2012) Sex in cheese: evidence for sexuality in the fungus Penicillium roqueforti. PLoS One 7(11): e49665. doi: 10.1371/journal.pone.0049665
Samuel AZ, Horii S, Nakashima T, et al. (2021) Raman microspectroscopy imaging analysis of extracellular vesicles (EVs) biogenesis by filamentous fungus Penicilium chrysogenum. bioRxiv 2021.11.04.467387; doi: 10.1101/2021.11.04.467387
Sánchez-Torres P (2021) Molecular Mechanisms Underlying Fungicide Resistance in Citrus Postharvest Green Mold. Journal of Fungi 7(9): 783. doi: 10.3390/jof7090783
Snowden AL (2008) Post-Harvest Diseases and Disorders of Fruits and Vegetables: Volume 1: General Introduction and Fruits. CRC Press. 320 p.
Taylor EL, Gottwald TR, Adkins S (2023) Structural changes in Florida citrus production, 1980-2021 and associated consequences of weather events and disease. Journal of Citrus Pathology, 10. doi: 10.5070/
Trinh J, Li T, Franco JY, et al. (2022) Citrus relatives exhibit natural variation in perception and response magnitude to microbial features. bioRxiv 2022.07.15.500235; doi: 10.1101/2022.07.15.500235
Vilanova L, Viñas I, Torres R, Usall J, Jauset AM, Teixidó N (2012) Infection capacities in the orange-pathogen relationship: compatible (Penicillium digitatum) and incompatible (Penicillium expansum) interactions. Food Microbiol. 29(1): 56-66. doi: 10.1016/j.fm.2011.08.016
Visagie CM, Houbraken J, Frisvad JC, et al. (2014) Identification and nomenclature of the genus Penicillium. Stud Mycol. 78: 343-371. doi: 10.1016/j.simyco.2014.09.001