.
Condición fitosanitaria: Presente
Grupo de cultivos: Hortícolas
Especie hospedante: Papa (Solanum turberosum L.)
Rango de hospedantes: Streptomyces tiene un amplio rango de hospedantes que comprende cultivos formadores de tubérculos como papa (Solanum tuberosum), la remolacha (Beta vulgaris), la zanahoria (Daucus carota), la chirivía (Pastinaca sativa), el rábano (Raphanus sativus), el colinabo (Brassica napobrassica) y el nabo (Brassica rapa). S. scabies también inhibe el crecimiento de plántulas en plantas monocotiledóneas y dicotiledóneas (Lerat et al., 2009). Las especies patógenas de Streptomyces no muestran un alto nivel de especificidad por el hospedante en condiciones controladas. Leiner et al. (1996) reportaron sobre el efecto de la inoculación con cepas virulentas de S. scabies en las plántulas de 14 plantas de cultivo, incluidas especies de monocotiledóneas y dicotiledóneas. La presencia de la bacteria patógena alteró negativamente el crecimiento de los brotes en 11 de las especies analizadas. Sin embargo, la variedad de hospedantes propensos a la infección por sarna común en condiciones de campo parece estar restringida a un número limitado de cultivos agrícolas (Goyer y Beaulieu, 1997). (*)
Etiología: Bacteria. Gram positiva filamentosa (**)
Agente causal: Streptomyces scabiei corrig. (ex Thaxter 1891) Lambert and Loria 1989; S. europaeiscabiei; S. turgidiscabies; S. acidiscabies; S. luridiscabiei sp. nov., S. puniciscabiei sp. nov.; S. niveiscabiei sp. nov. (*)
El cambio de nombre a Streptomyces scabies ocurrió en 1948, se revivió en 1989, pero luego se cambió a S. scabiei en 1997 para seguir la convención gramatical (Lambert y Loria, 1989). Sin embargo, el nombre S. scabies tiene un uso ampliamente aceptado, especialmente entre los investigadores de fitomejoramiento y manejo de enfermedades (Braun et al., 2017).
(*) En un estudio preliminar, Henao et al. (2021) detectaron las especies S. pratensis, S. xiamenensis y species desconocidas (sin poder clasificar), como patógenas causantes de sarna de la papa en Colombia.
.
Taxonomía: Bacteria > Terrabacteriagroup > Actinobacteria > Actinobacteria > Streptomycetales > Streptomycetaceae > Streptomyces
.
Las especies de Streptomyces son bacterias saprofitas que habitan en el suelo, de las cuales solo unas pocas causan enfermedades en las estructuras subterráneas de las plantas (Locci, 1994). Streptomyces scabies, agente causal de la sarna común en los tubérculos de papa (Solanum tuberosum), es la especie más conocida, pero no la única (Loria et al., 1997; Wanner, 2006). En la República Argentina se han reportado hasta la fecha tres especies fitopatógenas: S. scabies, S. acidiscabies y S. turgidiscabies (Barrera et al., 2013).
La producción de fitotoxinas llamadas taxtominas es esencial para la virulencia de los agentes comunes que causan la sarna. Los genes implicados en la vía biosintética de las taxtominas y otros genes de virulencia se agrupan en una gran isla de patogenicidad.
.
(**) El género Streptomyces tiene un ciclo de vida de desarrollo complejo (Flärdh y Buttner, 2009). Streptomyces tiene un crecimiento aéreo filamentoso y ramificado que produce esporas en cadenas, llamadas gonidios. Por lo tanto, S. scabies es una bacteria que se asemeja a los hongos debido a su morfología filamentosa. El micelio está compuesto por hifas delgadas (de aproximadamente 1 μm de diámetro), ramificadas, con pocas o ninguna pared transversal. Las esporas cilíndricas (0,5 por 0,9-1,0 μm) se producen en cadenas espirales maduras que contienen 20 o más esporas (Lambert y Loria, 1989). Las esporas se liberan de la punta de las hifas. En comparación con las endosporas formadas por especies de Bacillus, las esporas de Streptomyces son mucho menos resistentes a condiciones adversas, aunque pueden sobrevivir durante largos períodos de tiempo en un estado desecado (Flärdh y Buttner, 2009). Por tanto, parecería que las esporas de Streptomyces en gran parte latentes están bien adaptadas para la dispersión del organismo en el medio ambiente (Hopwood, 2007).
.
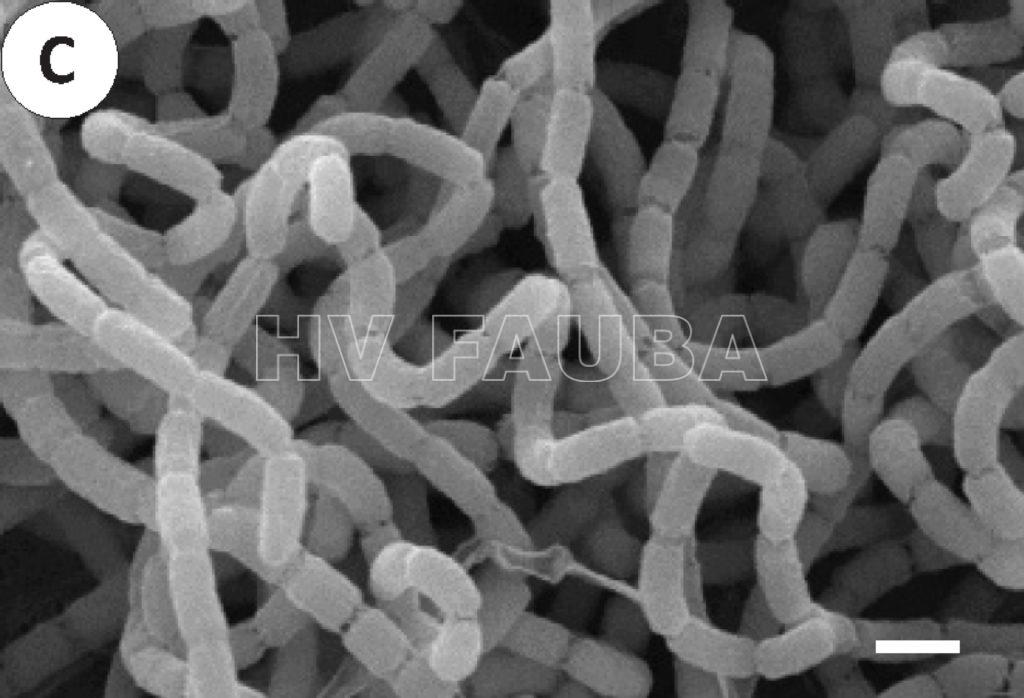
- Micrografía electrónica de barrido (SEM) de Streptomyces scabiei. La bacteria produce hifas espirales y tabiques de esporulación con constricciones. La barra de escala representa 1 μm. Autor: Lin et al. 2018
.
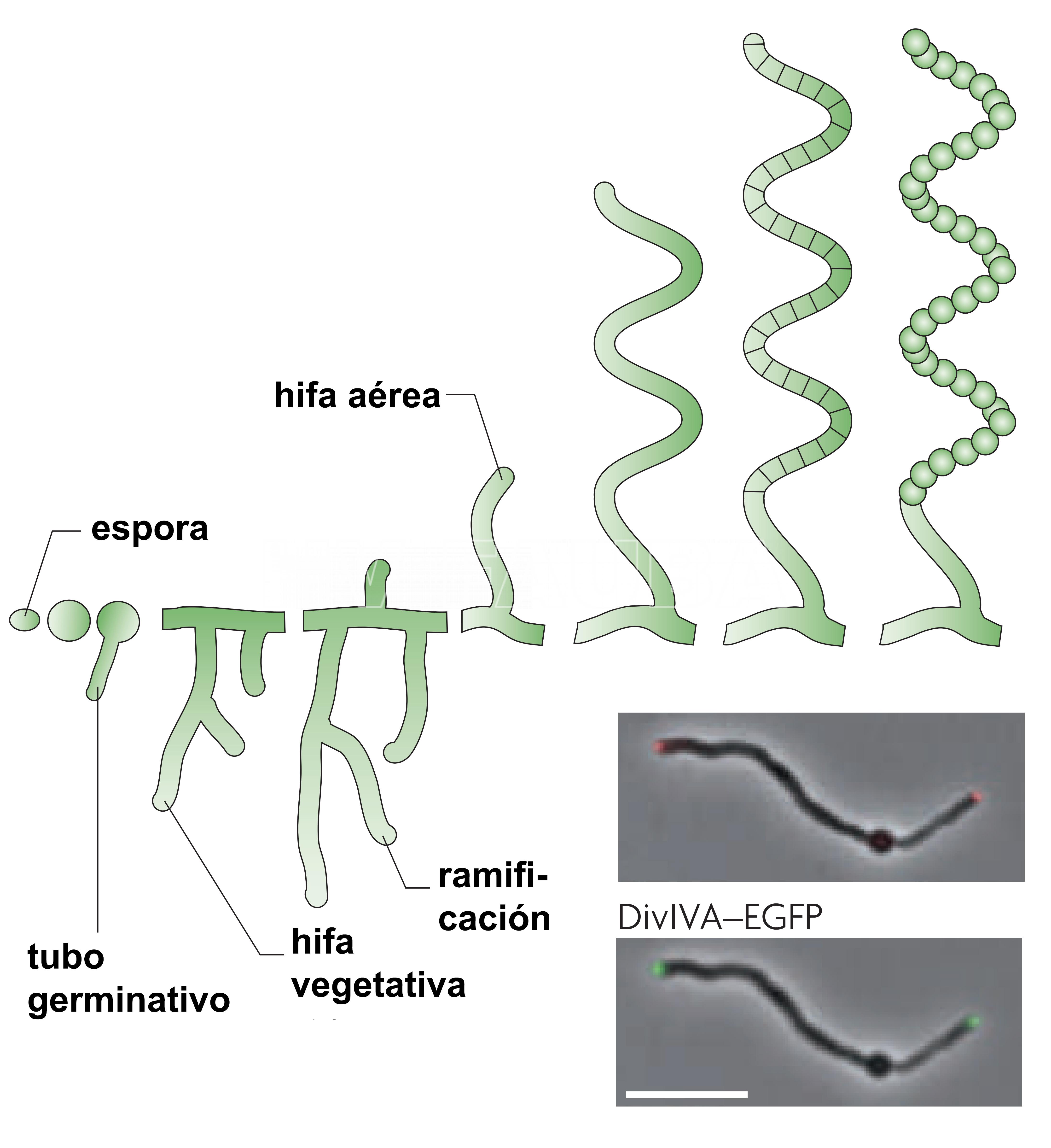
- Ciclo de vida de desarrollo de Streptomyces coelicolor. La barra de escala representa 6 µm. Autores: Flärdh y Buttner, 2009.
.
En la figura se esquematiza el desarrollo morfológico durante el ciclo de vida de S. coelicolor, otra especie de Streptomyces, a modo de ejemplo. La germinación de una espora implica hinchazón, polarización del crecimiento y aparición de un tubo germinativo que se convierte en hifa. Las hifas crecen por extensión de la punta y se ramifican en un micelio vegetativo que crece a lo largo y profundo del sustrato, dando lugar a la colonia vegetativa. En respuesta al agotamiento de nutrientes y otras señales, las hifas aéreas rompen la tensión superficial, escapan del ambiente acuoso y crecen en el aire. Las hifas aéreas se diferencian en una larga cadena de compartimentos de esporas, que luego desarrollan paredes de esporas gruesas, sintetizan un pigmento de esporas de policétido gris y desarrollan las otras características de las esporas maduras. Las esporas, en gran parte latentes, son el medio para la dispersión de este organismo en el medio ambiente y pueden eventualmente germinar cuando encuentran las condiciones adecuadas (Flärdh y Buttner, 2009).
.
.
Antecedentes
Entre las enfermedades bacterianas, la sarna común es la enfermedad más devastadora de la papa, causando pérdidas económicas significativas en los países productores de papa del mundo (Al-Mughrabi et al., 2016; Braun et al., 2017; Zhang et al., 2013; Slabbert et al., 2016; ). La distribución de esta enfermedad es generalizada, ya que actualmente está presente en todo el mundo, dondequiera que se cultive papa (Lerat et al., 2009). La sarna común de la papa está presente en todas la regiones productoras del cultivo de la Argentina. El agente causal de la sarna común de la papa se identificó por primera vez en América del Norte a fines del siglo XIX (Thaxter, 1892).
.
Síntomas
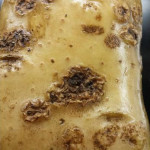
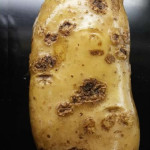
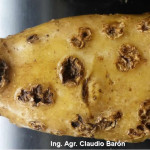
La enfermedad se caracteriza por la presencia de lesiones de apariencia corchosa en los tubérculos. Las lesiones más comunes son las superficiales y las profundas. Las lesiones superficiales se limitan a la cáscara del tubérculo y su aspecto puede variar desde una capa reticulada, a lesiones elevadas. Las lesiones profundas ingresan en el tubérculo produciendo hoyos de dimensiones variables, que en ocasiones se asemejan al daño causado por insectos del suelo. Un tubérculo puede tener los dos tipos de síntomas. Los síntomas superficiales desmerecen la calidad comercial de los tubérculos. A nivel de las lenticelas de los tallos subterráneos (tubérculos), aparecen pústulas corchosas o cráteres que se internan en el tubérculo. En ataques intensos, aumenta la posibilidad de penetración de organismos causantes de podredumbres secundarias durante el almacenaje de las papas.
Los síntomas comunes de la sarna común aparecen como lesiones corchosas poco profundas, elevadas o profundas distribuidas al azar. Su tamaño y color son bastante variables, pero las lesiones suelen ser de color marrón con un diámetro de unos pocos milímetros. Ningún síntoma por encima del suelo revela la presencia de la enfermedad, ya que los tejidos aéreos de las plantas infectadas con sarna permanecen sanos.
.
.
Patogénesis
(*) El proceso de infección del hospedante que conduce a la sarna común en condiciones naturales parece estar gobernado por complejas interacciones planta-patógeno (Dees et al., 2014; Jourdan et al., 2018). Algunos cultivares de papa se reconocen como resistentes o moderadamente sensibles a la enfermedad (Hiltunen et al., 2005).
Las especies patógenas de Streptomyces producen toxinas fitotóxicas como el thaxtomin (ThxA) (Bignell et al., 2014; Clarke et al., 2022), el coronafacoyl (Bown et al., 2017; Bown y Bignell, 2017) y fridamycin E (anthraquinone) (Natsume et al., 2018). Las taxtominas (thaxtomins), metabolitos secundarios producidos por cepas patógenas de Streptomyces, de la familia de las fitotoxinas dipéptidas modificadas, desempeñan un papel fundamental en el desarrollo de los síntomas de la sarna a través de la infección, colonización y destrucción de los tejidos de las raíces (Loria et al., 2006; Bignell et al., 2014). En la mayoría de las especies de Streptomyces patógenas, la taxtomina A es la forma predominante encontrada (King et al., 1992; Lerat et al., 2009). Cuando la toxina purificada se aplica a tejido vegetal, causa necrosis e hipertrofia celular, ambos síntomas de la infección del tubérculo por S. scabies (Lawrence et al. 1990). El sitio de acción de las taxtominas en la célula vegetal es un componente universal de las paredes celulares de las plantas, es decir, la celulosa (inhibidor de celulosa sintasa) (Lerat et al., 2009). Sin embargo, los mecanismos de acción de estas toxinas se han identificado solo parcialmente hasta la fecha. También se ha demostrado que la presencia de taxtomina activa los mecanismos de defensa de las plantas (Duval et al., 2005; Errakhi et al., 2008; Tegg et al., 2005). La regulación de la síntesis de taxtomina A es compleja. La biosíntesis de taxtomina A es inducida por la presencia de los polisacáridos vegetales celobiosa y celotriosa (Johnson et al., 2007; Wach et al., 2007). Aunque el compuesto de origen vegetal celobiosa ahora se reconoce como el inductor de la síntesis de taxtomina A a nivel genético, otras moléculas (incluidos los aminoácidos aromáticos y algunos metabolitos secundarios) muestran efectos inhibidores sobre la producción de la toxina. Se hipotetiza que la suberina estimula el metabolismo secundario y, por lo tanto, podría favorecer la producción de taxtomina (Lauzier et al., 2008; Lerat et al., 2010). Se ha demostrado que el gen ThxA inhibe la biosíntesis de celulosa, promueve la hipertrofia y causa la muerte celular programada en las células vegetales (Loria et al., 2003; Duval et al., 2005; Tegg et al., 2005). Los genes biosintéticos ThxA residen en una isla de patogenicidad móvil (PAI) en genomas de cepas patógenos de Streptomyces (Kers et al., 2005; Huguet-Tapia et al., 2011, 2012).
Recientemente, se ha reportado la toxina scabin, una ADP-ribosiltransferasa que actúa sobre el ADN (Lyons et al., 2016; Vatta et al., 2021). Scabin es una proteína de 22 kDa de 200 residuos que es una enzima de dominio único (Joshi et al., 2010).
Adiconalmente, estos investigadores confirmaron que la vía Tat secreta múltiples proteínas que son necesarias para una virulencia completa (Joshi et al., 2010). La principal característica distintiva del sistema Tat es que transporta proteínas completamente plegadas a través de la membrana citoplasmática. A pesar del hecho de que el sistema Tat es un sistema general de exportación de proteínas, las proteínas secretadas por Tat contribuyen a la virulencia en algunas bacterias Gram negativas y Gram positivas. Esta vía puede jugar un papel esencial en la virulencia de S. scabies. A través de estudios proteómicos junto con ensayos de secreción de proteínas informadoras, Joshi et al. (2010) verificaron 47 sustratos de Tat en este patógeno y demostraron que un mutante ΔtatC de S. scabies es casi completamente avirulento, y que la vía Tat secreta múltiples proteínas que son necesarias para la virulencia completa.
El gen nec1 participa en la patogenicidad y está físicamente ligado a los genes biosintéticos de la taxtomina A (Bukhalid et al., 1998). La secuencia de nec1 en S. scabies, S. acidiscabies, y las cepas de S. turgidiscabies es idéntica (Bukhalid et al., 1998).
.
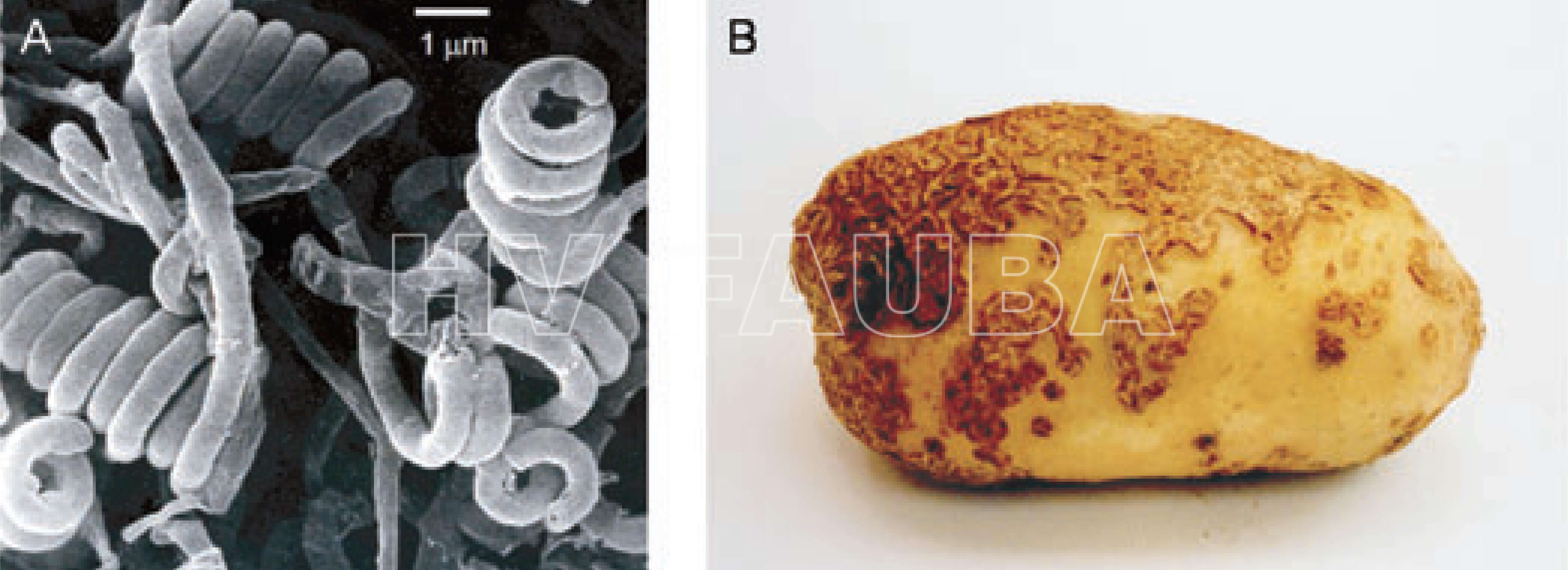
- (A) Micelio filamentoso de Streptomyces scabies observado con microscopía electrónica. El ciclo de vida eventualmente evoluciona hacia la formación de esporas a partir de cadenas espiraladas (gonidos). (B) Lesiones de sarna común en un tubérculo de papa. Autor: Lerat et al., 2009.
.
Condiciones predisponentes
Las condiciones favorables al desarrollo de la enfermedad son (Archuleta y Easton, 1981):
* PH del suelo de reacción neutra a alcalina / pH superior a 5.2.
* Temperaturas promedio de 20 a 22 ° C.
* Bajo contenido de humedad en el suelo durante las primeras semanas de desarrollo del tubérculo (inicio de floración) / humedad del suelo por debajo de la capacidad de campo durante la tuberización temprana.
.
.
Ciclo de la enfermedad y epidemiología
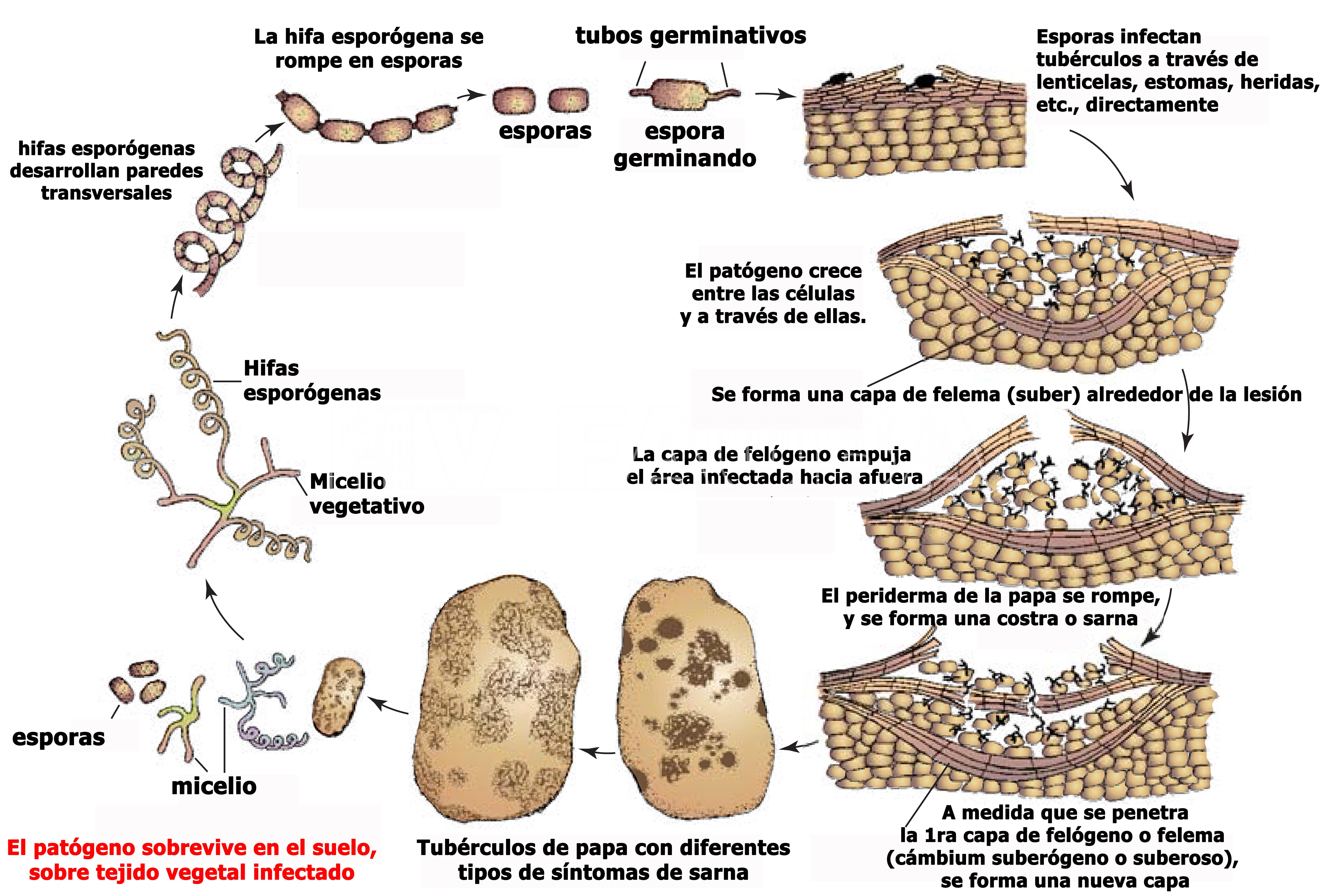
Las especies de Streptomyces son bacterias saprofitas que habitan el suelo, de las cuales solo unas pocas causan enfermedades en las estructuras subterráneas de las plantas (Locci, 1994). El patógeno se propaga a través del suelo y el agua y penetra en los tejidos a través de lenticelas, heridas y estomas en tubérculos jóvenes. La bacteria se dispersa por esporas y sobrevive en el suelo, en el agua del suelo y en las semillas (Agrios, 2005). La característica hidrofóbica de las esporas permite que también sean transportadas por artrópodos y nematodos (Loria et al. 2003; 2006). Las esporas germinan y entran en los tejidos de las plantas a través de heridas, sitios de alimentación de las larvas, estomas y lenticelas (Locci, 1994; Agrios, 2005). Se cree que la penetración de los tubérculos por S. scabies y otras especies patógenas de Streptomyces se produce a través de lenticelas jóvenes, probablemente porque aún no han formado una capa de suberina protectora (Locci, 1994). Loria et al. (2003) demostraron que la penetración y el crecimiento ocurren a través de las paredes celulares. Los tubérculos jóvenes son más susceptibles hasta tres o cuatro semanas después de la iniciación del tubérculo (Khatri et al., 2011; Agrios, 2005).
Epidemiológicamente se considera una enfermedad monocíclica.
.
.
- Ciclo de la enfermedad de la sarna común de la papa causada por Streptomyces scabies. Autor: Agrios, 2005.
.
.
Manejo Integrado
* Plantación de cultivares resistentes (ej. Frital INTA, Innovator, Markies, Umatilla Russet)
* Plantación de cultivares tolerantes o poco susceptibles (ej. Atlantic, Pampeana, INTA, Kelune INTA, Russet Burbank).
* Rotar el cultivo con maíz, trigo, cebada, alfalfa. Evitar las rotaciones con plantas hospedantes como: remolacha, zanahoria y trébol rojo. S. acidiscabies no sobrevive en plantas no hospedantes. Ver Larkin et al., 2011.
* Utilizar abonos verdes (Kinkel, 2008; Powelson and Rowe, 2008)
* Utilizar papa semilla sana.
* Tratamientos de papa semilla con fungicidas específicos (mancozeb, fluoxistrobin; fluazinan).
* Riego: especialmente en el período de inicio de tuberización. Mantener el suelo en capacidad de campo durante esta etapa de desarrollo tiende a disminuir la incidencia.
* Limitar los aportes de enmiendas calcáreas.
* Bajar pH suelo aplicando azufre o yeso, mantenerlo entre 5 a 5.2, utilizando fertilizantes que producen acidez como el sulfato de amonio, especialmente para controlar S. scabies. S. acidiscabies que desarrollan a pH de 4,5 a 5,2.
* Control biológico: ej. Bacillus (Lin et al., 2018); especies de Streptomyces promotoras del crecimiento, ej. Streptomyces A1RT (Sarwar et al., 2018; Kalantar Zadeh et al., 2006)
Las variedades susceptibles son: Spunta, Kennebec, Shepody, Russet Ranger. Spunta es susceptible a Phytopthora infestans, Sarna Común y PVLR, poco sensible a PVY
.
.
- 1 Sarna (Streptomyces scabies)
- 2 Sarna (Streptomyces scabies)
- 3 Sarna (Streptomyces scabies)
- Sarna de la Papa, causada por Streptomyces scabies
..
.
.
.
Bibliografía
Streptomyces scabiei. Sistema Nacional Argentino de Vigilancia y Monitoreo de plagas
Agrios G (2005) Plant Pathology. 5th Edition, Elsevier, eBook ISBN: 9780080473789
(2016) Management of common scab of potato in the field using biopesticides, fungicides, soil additives, or soil fumigants. Biocontrol Science and Technology 26: 125-135. doi: 10.1080/09583157.2015.1079809
Al-Quwaie DA (2024) The role of Streptomyces species in controlling plant diseases: a comprehensive review. Australasian Plant Pathol. 53: 1–14. doi: 10.1007/s13313-023-00959-z
Antony-Babu et al. (2017) Multiple Streptomyces species with distinct secondary metabolomes have identical 16S rRNA gene sequences. Scientific Reports 7: 11089. doi: 10.1038/s41598-017-11363-1
Archuleta JG, Easton GD (1981) The cause of deep-pitted scab of potatoes. American Potato Journal. 58: 385–392.
ARGENPAPA (2015) Principales Variedades de Papa cultivadas en la República Argentina. Link
Arseneault T, Pieterse CM, Gérin-Ouellet M, et al. (2014) Long-term induction of defense gene expression in potato by pseudomonas sp. LBUM223 and streptomyces scabies. Phytopathology 104(9): 926-32. doi: 10.1094/PHYTO-11-13-0321-R
Baranowska A, Zarzecka K, Gugała M, Mystkowska IT (2018) The Impact of the UGmax Soil Fertilizer on the Presence of Streptomyces scabies on Edible Potato Tubers. Journal of Ecological Engineering 19(3): 68-73. doi: 10.12911/22998993/85743
Barrera et al. (2013) Método especie-específico para la detección de especies patógenas de Streptomyces de suelo y tubérculos de papa en Argentina. Revista Argentina de Microbiología 45: 277-281. doi: 10.1016/S0325-7541(13)70037-3
Beaulieu C, Sidibé A, Jabloune R, et al. (2016) Physical, chemical and proteomic evidence of potato suberin degradation by the plant pathogenic bacterium Streptomyces scabiei. Microbes Environ. 31, 427–434. doi: 10.1264/jsme2.ME16110
Biessy A, Novinscak A, St-Onge R, et al. (2021) Inhibition of Three Potato Pathogens by Phenazine-Producing Pseudomonas spp. Is Associated with Multiple Biocontrol-Related Traits. mSphere 6(3): e0042721. doi: 10.1128/mSphere.00427-21
Bignell D, Fyans J, Cheng Z (2014) Phytotoxins produced by plant pathogenic Streptomyces species. Journal of Applied Microbiology 116: 223-235. doi: 10.1111/jam.12369
Bown L, Li Y, Berrué F, et al. (2017) Coronafacoyl phytotoxin biosynthesis and evolution in the common scab pathogen Streptomyces scabiei. Applied and Environmental Microbiology 83: e01169-17. doi: 10.1128/AEM.01169-17
Bown L, Bignell DR (2017) Purification of N-coronafacoyl Phytotoxins from Streptomyces scabies. Bio-protocol 7(7): e2214. doi: 10.21769/BioProtoc.2214.
Braun S, Gevens A, Charkowski A, et al. (2017) Potato Common Scab: a Review of the Causal Pathogens, Management Practices, Varietal Resistance Screening Methods, and Host Resistance. Am. J. Potato Res. 94: 283–296. doi: 10.1007/s12230-017-9575-3
Bukhalid RA, Chung SY, Loria R (1998) nec1, a gene conferring a necrogenic phenotype, is conserved in plant-pathogenic Streptomyces spp. and linked to a transposase pseudogene. Mol. Plant Microbe Interact. 11: 960–967. doi: 10.1094/MPMI.1998.11.10.960
Chapleau M, Guertin JF, Farrokhi A, et al. (2016) The toxicogenic region in S. scabiei strains. Molecular Plant Pathology 17: 501-509. doi: 10.1111/mpp.12296
Chater KF (2016) Recent advances in understanding Streptomyces. F1000Research 5: 2795. doi: 10.12688/f1000research.9534.1
Cheng Z, Bown L, Tahlan K, Bignell DRD (2015) Regulation of Coronafacoyl Phytotoxin Production by the PAS-LuxR Family Regulator CfaR in the Common Scab Pathogen Streptomyces scabies. PLoS ONE 10(3): e0122450. doi: 10.1371/journal.pone.0122450
Clark LC, Hoskisson PA (2011) Duplication and Evolution of devA-Like Genes in Streptomyces Has Resulted in Distinct Developmental Roles. PLoS ONE 6(10): e25049. doi: 10.1371/journal.pone.0025049
Clarke CR, Kramer CG, Kotha RR, Luthria DL (2022) The Phytotoxin Thaxtomin A Is the Primary Virulence Determinant for Scab Disease of Beet, Carrot, and Radish Caused by Streptomyces scabiei. Phytopathology 112(11): 2288-2295. doi: 10.1094/PHYTO-03-22-0072-R
Dees MW, Sletten A, Hermansen A (2013) Isolation and characterization of Streptomyces species from potato common scab lesions in Norway. Plant Pathology 62: 217-225. doi: 10.1111/j.1365-3059.2012.02619.x
Dees M, Lysøe E, Brurberg M, et al. (2014) Global gene expression in the common scab pathogen, Streptomyces scabies, exposed to potato microtubers. Ann Appl Biol. 165: 43-52. doi: 10.1111/aab.12106
Doumbou CL, Akimov V, Côté M, et al. (2001) Taxonomic Study on Nonpathogenic Streptomycetes Isolated from Common Scab Lesions on Potato Tubers. Systematic and Applied Microbiology 24(3): 451-456. doi: 10.1078/0723-2020-00051
Duval I, Brochu V, Simard M, et al. (2005) Thaxtomin A induces programmed cell death in Arabidopsis thaliana suspension-cultured cells. Planta 222(5): 820–831. doi: 10.1007/s00425-005-0016-z
Enciso-Rodriguez F, Douches D, Lopez-Cruz M, et al. (2018) Genomic Selection for Late Blight and Common Scab Resistance in Tetraploid Potato (Solanum tuberosum). G3 (Bethesda) 8(7): 2471-2481. doi: 10.1534/g3.118.200273
Errakhi R, Dauphin A, Meimoun P, et al. (2008) An early Ca2+ influx is a prerequisite to thaxtomin A-induced cell death in Arabidopsis thaliana cells. J Exp Bot. 59(15): 4259-70. doi: 10.1093/jxb/ern267
Fiers M, Edel-Hermann V, Chatot C, et al. (2012) Potato soil-borne diseases. A review. Agron. Sustain. Dev. 32: 93–132. doi: 10.1007/s13593-011-0035-z
Flärdh K, Buttner M (2009) Streptomyces morphogenetics: dissecting differentiation in a filamentous bacterium. Nat Rev Microbiol 7: 36–49. doi: 10.1038/nrmicro1968
Fofana B, Somalraju A, Fillmore S, et al. (2020) Comparative transcriptome expression analysis in susceptible and resistant potato (Solanum tuberosum) cultivars to common scab (Streptomyces scabies) revealed immune priming responses in the incompatible interaction. PLoS One 15(7): e0235018. doi: 10.1371/journal.pone.0235018
Fyans JK, Bignell D, Loria R, et al. (2013) S. scabies type VII secretion system. Molecular Plant Pathology 14: 119-130. doi: 10.1111/j.1364-3703.2012.00835.x
(1997) Host range of streptomycetes strains causing common scab. Plant Disease 81: 901–904. doi: 10.1094/PDIS.1997.81.8.901
Hao JJ, Meng QX, Yin JF, Kirk WW (2009) Characterization of a New Streptomyces Strain, DS3024, That Causes Potato Common Scab. Plant Disease 93(12): 1329-1334. doi: 10.1094/PDIS-93-12-1329
Hao J, Ashley K (2021) Irreplaceable Role of Amendment-Based Strategies to Enhance Soil Health and Disease Suppression in Potato Production. Microorganisms 9(8): 1660. doi: 10.3390/microorganisms9081660
Henao L, Guevara M, Restrepo S, Husserl J (2021) Genotypic and phenotypic characterization of Streptomyces species associated with potato crops in the central part of Colombia. Plant Pathology 00: 1– 12. doi: 10.1111/ppa.13485
(2005) A mail survey of growers to estimate potato common scab prevalence and economic loss in Canada. Canadian Journal of Plant Pathology 27: 46–52. doi: 10.1080/07060660509507192
, , , (2005) Responses of potato cultivars to the common scab pathogens, Streptomyces scabies and S. turgidiscabies. Ann. Appl. Biol. 146: 395–403. doi: 10.1111/j.1744-7348.2005.040083.x
Hopwood DA (2007) Streptomyces in Nature and Medicine. Oxford Univ. Press, New York. Link
Hosny M, et al. (2018) Comparison between Pathogenic Streptomyces scabies Isolates of Common Scab Disease. Notulae Scientia Biologicae 8(2): 151-155. doi: 10.15835/nsb829819
Huguet-Tapia JC, Badger JH, Loria R, Pettis GS (2011) Streptomyces turgidiscabies Car8 contains a modular pathogenicity island that shares virulence genes with other actinobacterial plant pathogens. Plasmid 65(2):118–24. doi: 10.1016/j.plasmid.2010.11.002
Huguet-Tapia JC, Loria R (2012) Draft genome sequence of Streptomyces acidiscabies 84-104, an emergent plant pathogen. J Bacteriol. 194(7): 1847. doi: 10.1128/JB.06767-11
Ismail S, Jiang B, Nasimi Z (2020) Investigation of Streptomyces scabies causing potato scab by various detection techniques, its pathogenicity and determination of host-disease resistance in potato germplasm. Pathogens 9(9): 760. doi: 10.3390/pathogens9090760
Jayaraman S, Naorem A, Lal R, et al. (2021) Disease-Suppressive Soils—Beyond Food Production: a Critical Review. J Soil Sci Plant Nutr 21: 1437–1465. doi: 10.1007/s42729-021-00451-x
, , (2007) Cello-oligosaccharides released from host plants induce pathogenicity in scab-causing Streptomyces species. Physiol. Mol. Plant Pathol. 71: 18–25. doi: 10.1016/j.pmpp.2007.09.003
Joshi MV, Mann SG, Antelmann H, et al. (2010) The twin arginine protein transport pathway exports multiple virulence proteins in the plant pathogen Streptomyces scabies. Mol Microbiol. 77(1): 252-71. doi: 10.1111/j.1365-2958.2010.07206.x
Jourdan S, Francis IM, Deflandre B, et al. (2018) Contribution of the β‐glucosidase BglC to the onset of the pathogenic lifestyle of Streptomyces scabies. Molecular Plant Pathology 19: 1480-1490. doi: 10.1111/mpp.12631
Kalantar Zadeh M, Shahidi Bonjar G, Rashid Farrokhi P, et al. (2006) Antagonistic potential of two native Streptomyces strains in biocontrol of the major causals of common scab of potato in Iran. Asian J. Plant Sci. 5: 5–8. Link
Kers JA, Cameron KD, Joshi MV, et al. (2005) A large, mobile pathogenicity island confers plant pathogenicity on Streptomyces species. Mol Microbiol. 55(4):1025–33. doi: 10.1111/j.1365-2958.2004.04461.x
Khalil M, Lerat S, Beaudoin N, Beaulieu C (2019) The Plant Pathogenic Bacterium Streptomyces scabies Degrades the Aromatic Components of Potato Periderm via the β-Ketoadipate Pathway. Front. Microbiol. 10:2795. doi: 10.3389/fmicb.2019.02795
Khatri BB, Tegg RS, Brown PH, Wilson CR (2011) Temporal association of potato tuber development with susceptibility to common scab and Streptomyces scabiei‐induced responses in the potato periderm. Plant Pathology 60: 776-786. doi: 10.1111/j.1365-3059.2011.02435.x
, (1992) Chemistry of phytotoxins associated with Streptomyces scabies, the causal organism of potato scab. J. Agric. Food Chem. 40: 834–837. doi: 10.1021/jf00017a025
Kinkel L (2008) Soil health: managing the soil microflora to enhance potato health. In: Potato health management, ed. D. Johnson, 2nd ed. St. Paul: APS Press.
Kitani S, Hoshika M, Nihira T (2008) Disruption of sscR encoding a γ-butyrolactone autoregulator receptor in Streptomyces scabies NBRC 12914 affects production of secondary metabolites. Folia Microbiol. 53: 115–124. doi: 10.1007/s12223-008-0017-y
Komeil D, Padilla-Reynaud R, Lerat S, et al. (2014) Comparative secretome analysis of Streptomyces scabiei during growth in the presence or absence of potato suberin. Proteome Science 12: 35. doi: 10.1186/1477-5956-12-35
Lambert D, Loria R (1989) Streptomyces scabies SP-Nov, nomrev. International Journal of Systematic and Evolutionary Microbiology 39: 387–392.
Landwehr W, Kämpfer P, Glaeser S, et al. (2017) Taxonomic analyses of members of the Streptomyces cinnabarinus cluster, description of Streptomyces cinnabarigriseus sp. nov. and Streptomyces davaonensis sp. nov. International Journal of Systematic and Evolutionary Microbiology 68(1): 382-393. doi: 10.1099/ijsem.0.002519
Larkin RP, Honeycutt CW, Griffin TS, et al. (2011) Effects of different potato cropping system approaches and water management on soil borne diseases and soil microbial communities. Phytopathology 101: 58–67. doi: 10.1094/PHYTO-04-10-0100
Lauzier A, Simao-Beaunoir A-M, Bourassa S, et al. (2008) Effect of potato suberin on Streptomyces scabies proteome. Mol. Plant Pathol. 9: 753–762. doi: 10.1111/j.1364-3703.2008.00493.x
Lawrence CH, Clark MC, King RR (1990) Induction of common scab symptoms in aseptically cultured potato tubers by the vivotoxin, thaxtomin. Phytopathology 80: 606-608. doi: 10.1094/Phyto-80-606
Lehtonen MJ, Rantala H, Kreuze JF, et al. (2004) Occurrence and survival of potato scab pathogens (Streptomyces species) on tuber lesions: quick diagnosis based on a PCR-based assay. Plant Pathol 53: 280–287. doi: 10.1111/j.0032-0862.2004.01009.x
Leiner RH, Fry BA, Carling DE, Loria R (1996) Probable involvement of thaxtomin A in pathogenicity of Streptomyces scabies on seedlings. Phytopathology 86: 709–713. doi: 10.1094/Phyto-86-709
Lerat S, Simao-Beaunoir AM, Beaulieu C (2009) Genetic and physiological determinants of Streptomyces scabies pathogenicity. Molecular plant pathology 10(5): 579-85. doi: 10.1111/j.1364-3703.2009.00561.x
Lerat S, Simao-Beaunoir AM, Wu R, et al. (2010) Involvement of the plant polymer Suberin and the disaccharide cellobiose in triggering thaxtomin A biosynthesis, a phytotoxin produced by the pathogenic agent streptomyces scabies. Phytopathology 100(1): 91-6. doi: 10.1094/PHYTO-100-1-0091
Lin C, Tsai C-H, Chen P-Y, et al. (2018) Biological control of potato common scab by Bacillus amyloliquefaciens Ba01. PLoS ONE 13(4): e0196520. doi: 10.1371/journal.pone.0196520
(1994) Actinomycetes as plant pathogens. European Journal of Plant Pathology 100, 179–200. doi: 10.1007/BF01876235
, , , 1997) Plant pathogenicity in the genus Streptomyces. Plant Disease 81: 836–46. doi: 10.1094/PDIS.1997.81.8.836
Loria R (2001) Common scab. En: Compendium of potato diseases, Stevenson WR, Loria R, Franc GD, Weingartner DP (Eds.), 2nd ed., 14–15. St. Paul: The American Phytopathological Society.
Loria R, Coombs J, Yoshida M, et al. (2003) A paucity of bacterial root diseases: Streptomyces succeeds where others fail. Physiological and Molecular Plant Pathology 62: 65–72. doi: 10.1016/S0885-5765(03)00041-9
Loria R, Kers J, Joshi M (2006) Evolution of plant pathogenicity in Streptomyces. Annual Review of Phytopathology 44: 469-87. doi: 10.1146/annurev.phyto.44.032905.091147
Lyons B, Ravulapalli R, Lanoue J, et al. (2016) Scabin, a novel DNA-acting ADP-ribosyltransferase from Streptomyces scabies. J. Biol. Chem. 291: 11198–11215. doi: 10.1074/jbc.M115.707653
Mao M-Y, Li M, Lei L, et al. (2018) The Regulator Gene rnc Is Closely Involved in Biofilm Formation in Streptococcus mutans. Caries Res 52: 347–358. doi: 10.1159/000486431
Meng Q, Hao JJ (2017) Optimizing the application of Bacillus velezensis BAC03 in controlling the disease caused by Streptomyces scabies. BioControl 62(4): 535-544. doi: 10.1007/s10526-017-9799-7
Natsume M, Nagagata A, Aittamaa M, et al. (2018) Phytotoxin produced by the netted scab pathogen, Streptomyces turgidiscabies strain 65, isolated in Sweden. Journal of General Plant Pathology 84(2): 108–117. doi: 10.1007/s10327-018-0765-8
Paré MC, Legault J, Pichette A, et al. (2017) Canadian goldenrod residues and extracts inhibit the growth of Streptomyces scabiei, the causal agent of potato common scab. Canadian Journal of Plant Pathology 40(1): 70-75. doi: 10.1080/07060661.2017.1406992
Park D, Kim J, Kwon S, et al. (2003) Streptomyces luridiscabiei sp. nov., Streptomyces puniciscabiei sp. nov. and Streptomyces niveiscabiei sp. nov., which cause potato common scab disease in Korea. Int J Syst Evol Microbiol 53(6):2049-2054. doi: 10.1099/ijs.0.02629-0
Powelson M, Rowe R (2008) Managing diseases caused by seedborne and soilborne fungi and fungus-like pathogens. In Potato health management, ed. D. Johnson, 2nd ed., 183–195. St. Paul, MN: APS Press.
Rapoport D, Patrmanova T, Kopecky J, et al. (2020) Isolation of streptomycetes causing common scab from 3-years old potato samples from South America. Agronomy Research 18(S2): 1433–1443. doi: 10.15159/AR.20.157
Roman-Reyna V, Rioux RA, Babler BN, et al. (2022) Concept Note: Toward Metagenomic Sequencing for Rapid, Sensitive, and Accurate Detection of Bacterial Pathogens in Potato Seed Production. PhytoFrontiers™ . doi: 10.1094/PHYTOFR-04-22-0037-FI
Sarwar A, Latif Z, Zhang S, et al. (2018) Biological control of potato common scab with rare isatropolone C compound produced by plant growth promoting Streptomyces A1RT. Front. Microbiol. 9:1126. doi: 10.3389/fmicb.2018.01126
Shepherdson EMF, Elliot MA (2022) Cryptic specialized metabolites drive Streptomyces exploration and provide a competitive advantage during growth with other microbes. Proc Natl Acad Sci U S A. 119(40): e2211052119. doi: 10.1073/pnas.2211052119
Shi W, Li M, Wei G, et al. (2019) The occurrence of potato common scab correlates with the community composition and function of the geocaulosphere soil microbiome. Microbiome 7, 14. doi: 10.1186/s40168-019-0629-2
Slabbert R, Klerk AD, Pretorius E (1994) Isolation of the phytotoxin thaxtomin A associated with Streptomyces scabies (common scab) in potatoes. J. S. Afr. Soc. Hortic. Sci. 4: 33–34. Link
Suárez-Moreno ZR, Vinchira-Villarraga DM, Vergara-Morales DI, et al. (2019) Plant-Growth Promotion and Biocontrol Properties of Three Streptomyces spp. Isolates to Control Bacterial Rice Pathogens. Front. Microbiol. 10: 290. doi: 10.3389/fmicb.2019.00290
Sun H, Jiao WB, Krause K, et al. (2022) Chromosome-scale and haplotype-resolved genome assembly of a tetraploid potato cultivar. Nat Genet. doi: 10.1038/s41588-022-01015-0
Tegg RS, Melian L, Wilson CR, Shabala S (2005) Plant cell growth and ion flux responses to the streptomycete phytotoxin thaxtomin A: calcium and hydrogen flux patterns revealed by the non-invasive MIFE technique. Plant Cell Physiol. 46(4): 638–648. doi: 10.1093/pcp/pci069
(1892) Potato scab. Conn. Agric. Exp. Stn. 1891, 153–160.
Tomihama T, Nishi Y, Sakai M, et al. (2016) Draft genome sequences of Streptomyces scabiei S58, Streptomyces turgidiscabies T45, and Streptomyces acidiscabies a10, the pathogens of potato common scab, isolated in Japan. Genome Announc 4(2):e00062-16. doi: 10.1128/genomeA.00062-16
van Bergeijk DA, Terlouw BR, Medema MH, et al. (2020) Ecology and genomics of Actinobacteria: new concepts for natural product discovery. Nat Rev Microbiol 18: 546–558. doi: 10.1038/s41579-020-0379-y
Vatta M, Lyons B, Heney KA, et al. (2021) Mapping the DNA-Binding Motif of Scabin Toxin, a Guanine Modifying Enzyme from Streptomyces scabies. Toxins 13(1): 55. doi: 10.3390/toxins13010055
Viaene T, Langendries S, Beirinckx S, et al. (2006) Streptomyces as a plant’s best friend? FEMS Microbiol Ecol. 92(8): fiw119. doi: 10.1093/femsec/fiw119
Vurukonda SSKP, Giovanardi D, Stefani E (2018) Plant Growth Promoting and Biocontrol Activity of Streptomyces spp. as Endophytes. International Journal of Molecular Science 19(4), 952. doi: 10.3390/ijms19040952
, , (2007) Effect of carbohydrates on the production of thaxtomin A by Streptomyces acidiscabies. Arch. Microbiol. 188: 81–88. doi: 10.1007/s00203-007-0225-x
(2006) A survey of genetic variation in Streptomyces isolates causing potato common scab in the United States. Phytopathology 96: 1363–1371. doi: 10.1094/PHYTO-96-1363
Wanner LA (2009) A Patchwork of Streptomyces Species Isolated from Potato Common Scab Lesions in North America. Am. J. Pot Res 86: 247–264. doi: 10.1007/s12230-009-9078-y
Widdick DA, Hicks MG, Thompson BJ, et al. (2011) Dissecting the complete lipoprotein biogenesis pathway in Streptomyces scabies. Molecular Microbiology 80: 1395-1412. doi: 10.1111/j.1365-2958.2011.07656.x
Xu R, Falardeau J, Avis T, Tambong J (2016) HybProbes‐based real‐time PCR assay for specific identification of Streptomyces scabies and Streptomyces europaeiscabiei, the potato common scab pathogens. Letters in Applied Microbiology 62: 153-159. doi: 10.1111/lam.12522
Zhang J, Yin Y, Yan R, et al. (2013) Occurrence and control approach of potato common scab (caused by Streptomyces scabiei) in Nei Menggu. Chin. Potato J. 27: 56–59. Link