.
Condición fitosanitaria: Presente
Grupo de cultivos: Hortícolas
Especie hospedante: Pimiento (Capsicum annuum var. annuum)
Rango de hospedantes: amplio, puede infectar más de 550 especies de plantas de 70 famílias botánicas. En papa la enfermedad es conocida como “Top necrosis” (Salvalaggio et al., 2017).
Epidemiología: policíclica, subaguda.
Etiología: Virus. (Biótrofo como todos los virus)
Agente causal: Tomato spotted wilt virus (Tospovirus, TSWV)
Taxonomía:
Viruses > Riboviria > Orthornavirae > Negarnaviricota > Polyploviricotina > Ellioviricetes > Bunyavirales > Tospoviridae > Orthotospovirus > Orthotospovirus tomatomaculae
ICTV: ssRNA negative-strand viruses > TSWV
ICTB Taxonomy history: Orthotospovirus tomatomaculae
Baltimore classification: Group IV: ssRNA(-) Baltimore, 1971
.
.
.
Antecedentes
La enfermedad se denomina «Peste negra, marchitamiento manchado o moteado». El agente causal es el Tomato Spotted Wilt Virus (TSWV), aislado originalmente a partir de plantas de tomate enfermas (ver Peste negra del tomate). TSWV infecta a más de 1000 especies de plantas y causa daño económico significativo a muchos cultivos hortícolas, ornamentales y espontáneas pertenecientes a 70 familias botánicas. TSWV se describió por primera vez en plantas de tomate infectadas en Australia en 1915 y se determinó que era de etiología viral en 1930. En algunas áreas, se ha determinado que el virus es omnipresente en el medio ambiente, ya que puede infectar muchas malezas, plantas de jardinería y plantas nativas (Sherwood et al., 2009).
El virus es transmitido exclusivamente por trips.
.
Síntomas
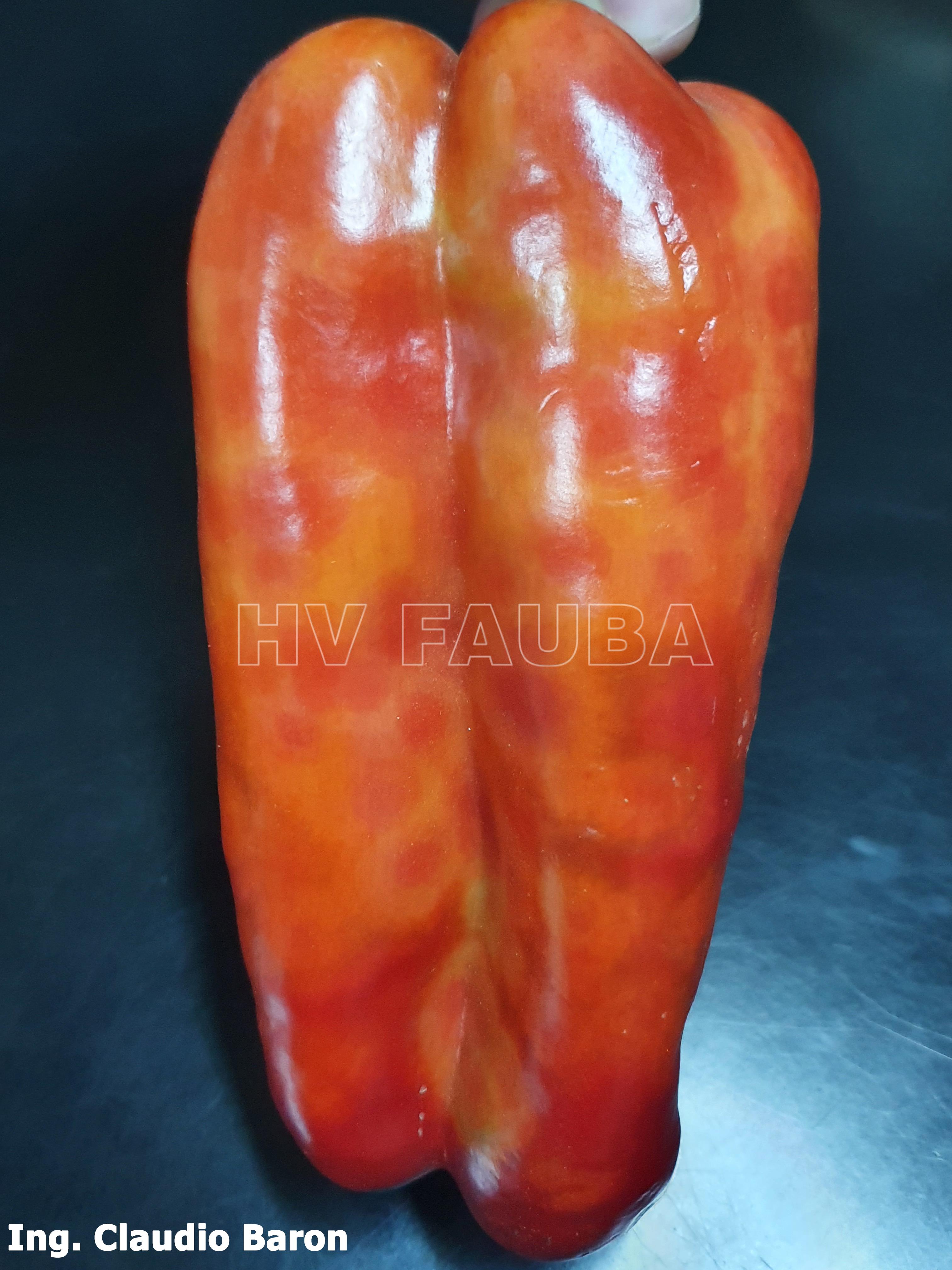
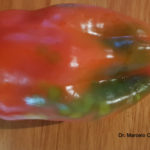
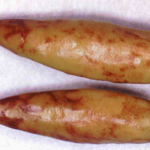
Los más característicos consisten en la aparición de pequeñas manchas anilladas en las hojas superiores que rápidamente se vuelven homogéneas y de color bronceado. Las hojas se abarquillan hacia abajo y aparecen estrías oscuras en pecíolos y tallos. Los brotes terminan necrosándose. Los frutos presentan tamaño reducido, deformaciones y manchas anilladas concéntricas de color amarillo que perduran hasta la madurez.Como en la mayoría de las virosis, las plantas presentan detención del crecimiento y clorosis generalizada.
.
- Autor: Gerald Holmes, Strawberry Center, Cal Poly San Luis Obispo.
- Autor: Ing. Claudio Baron
- Autor: Ing. Claudio Baron
- Autor: Ed Sikora



.
.
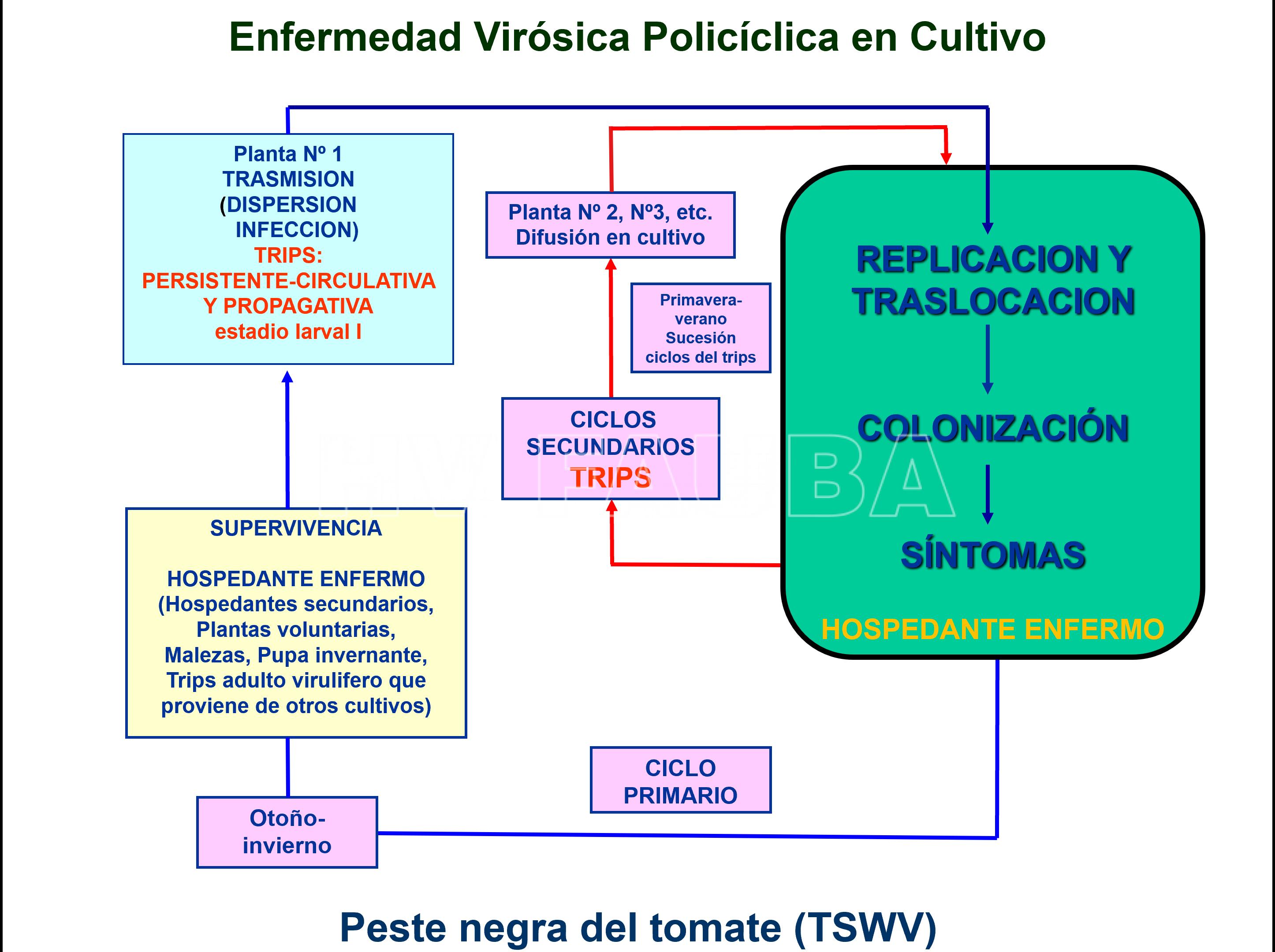
Vectores, diseminación (transmisión) del virus
El virus es transmitido exclusivamente por trips de manera persistente propagativa, es decir, el virus se replica tanto en las células de las plantas hospedantes como en las células de los insectos vectores (trips) (Oliver & Whitfield, 2016). Existen diferencias significativas en los tospovirus y su relación con especies específicas de trips. En Argentina, las principales especies de trips que se comportan como vectores del TSWV son: Frankliniella occidentalis, F. schultzei, F. gemina, F. fusca, Trips tabaci, T. setosus, T. palmi, Scirtothrips dorsalis, siendo las tres primeras las más eficientes e importantes. Se ha demostrado que el insecto adquiere la partícula viral en el estado larval I (L1), y lo transmite en las formas de estado larval II (L2) y adulto (van de Wetering et al., 1996, 1996, 1999; Wijkamp et al., 1993. 1995; de Borbón et al., 2006). La ruta de diseminación y acumulación del TSWV desde el intestino medio hasta la glándula salival en el insecto vector (trips) está estrechamente relacionada con el desarrollo de los insectos. El TSWV se adquiere durante la alimentación de los estadios larvales (L1 y L2), persiste a través del desarrollo de la pupa (P1 y P2) y se acumula en las glándulas salivales de los adultos (Nagata et al., 2002). Las larvas en estadio I (L1) recién emergidas son las más eficientes en adquirir el virus y la eficiencia disminuye a medida que las larvas envejecen (Moritz et al., 2004). Solo los adultos que se habían alimentado de plantas infectadas como larvas pueden inocular plantas y son la etapa principal de transmisión de planta a planta porque tienen alas y son muy móviles. Los trips adultos que se alimentan de tejido infectado pueden adquirir virus, pero son reacios a inocular el virus en la planta hospedante. La partícula viral de TSWV no se transmite transováricamente (Wijkamp et al., 1996); las larvas deben emerger del tejido infectado y alimentarse para establecer la próxima generación de adultos inoculadores. Los viriones ingeridos con tejidos vegetales infectados se unen y entran en el epitelio de la región anterior del intestino medio, la principal barrera para la adquisición del virus (Whitfield et al., 2005), donde luego se replica y se disemina a las células musculares viscerales circundantes. La replicación ocurre en las células musculares viscerales y las principales glándulas salivales del insecto (Montero-Astúa et al., 2016, Ullman et al., 1993, Ullman et al., 1995, Wijkamp et al., 1995). Recientemente se documentó que el virus se acumula en las glándulas salivales tubulares de adultos de F. occidentalis y que la extensión de la infección / acumulación del virus es mayor en las glándulas salivales principales en comparación con otros sistemas tisulares (Montero-Astúa et al., 2016). Además, la habilidad (Montero-Astua et al., 2014) y la capacidad (Rotenberg et al., 2009) de F. occidentalis para inocular plantas parece depender de la dosis del virus, es decir, la abundancia relativa de la nucleocápside N del TSWV, utilizada como un proxy para el título de virus. Esto se correlacionó positivamente con la eficiencia (proporción de adultos inoculantes) y la frecuencia (número de eventos de inoculación por individuo) de la inoculación de plantas, respectivamente. La caracterización de la interacción molecular entre el virus y el vector a lo largo del ciclo de vida del insecto puede proporcionar una mayor comprensión de los factores que modulan el éxito del proceso de transmisión (Schneweis et al., 2017).
La mayoría de las especies de vectores tienen una alta fecundidad y ciclos reproductivos cortos. Las especies de trips que transmiten TSWV son insectos polífagos, chupadores y perforadores que se alimentan de una variedad de tipos de células. Para alimentarse, el insecto perfora la epidermis de la hoja e ingiere el citoplasma de las células del mesófilo, ya sea colapsando células individuales o destruyendo varias células. Se observaron orgánulos y viriones de plantas intactos en tripas de trips con el uso de microscopía electrónica.
.
* Adquisición como larva: 30 min (alimentación profunda)
* Permance en la muda
* Latencia: 3-10 días
* Transmisión: 5-30 min (alimentación superficial)
* No se transfiere a la progenie
.
- Frankliniella occidentalis adulto.
- Frankliniella occidentalis pupa.
- Frankliniella occidentalis en segundo estado larval.
- Frankliniella occidentalis en primer estado larval.
.
Ciclo de la Enfermedad
El vector adquiere el virus en su forma de su estadío larval I al alimentarse de malezas o plantas cultivadas enfermas. La concentración viral aumenta en su interior en la medida que el insecto va cumpliendo su ciclo, que puede durar entre diez a cuarenta días según las temperaturas varíen entre 15ºC a 30ºC, respectivamente. El virus, una vez adquirido, puede ser transmitido por todos los estadíos sucesivos y necesita un período de latencia de entre cuatro a dieciocho días. El adulto, que es la forma diseminante del virus en el cultivo, no puede adquirirlo ni transmitirlo a la descendencia pero, al oviponer sobre plantas enfermas, las formas larvales eclosionadas adquieren el virus para reiniciar el ciclo. Dentro del invernadero, debido a las condiciones favorables, los ciclos se acortan y las distintas generaciones, que pueden ser partenogénicas, se van solapando coexistiendo todos los estadíos. Los vectores pueden también invernar como ninfa infectada y transmitir el virus como adulto en los vuelos de primavera.
.
- Ciclo de la peste negra del tomate y el pimiento, causados por el TSWV. El ciclo de vida del trip vector desde huevo hasta adulto puede variar entre 15 a 40 días, dependiendo del rango de temperaturas predominante.
- Autor: Ing. Agr. Claudio Baron
.
.
Manejo Integrado
Como en toda enfermedad de origen virósico, el manejo debe apuntar a la prevención. Cuando sea posible se deben elegir materiales con tolerancia o resistencia a la enfermedad y se deberá asegurar la sanidad de los plantines a transplantar. Durante el cultivo se debe monitorear y combatir al vector comenzando cuando se adviertan los primeros adultos. Por otra parte, bajo invernáculo se debe eliminar malezas y se debe proceder del mismo modo con las plantas de pimiento y tomate cuando se observen síntomas de ésta u otra virosis. La resistencia puede quebrarse facilmente (Sharman y Persley, 2006; Crescenzi et al., 2013; Ferrand et al., 2015; Ferrand et al., 2019).
En pimiento la resistencia a TSWV ha sido adquirida mediante el gen Tsw de Capsicum chinensis, el cual se introgresó a pimientos comerciales (pimientos Tsw+). En el Cinturón hortícola platense (CHP) se incorporaron variedades de pimiento Tsw+ y de tomate Sw-5b+, controlando la enfermedad durante varios años. Sin embargo, en 2008 comenzaron a observarse plantas de pimiento Tsw+ con sintomatología de peste negra. Posteriormente, Ferrand (2017) confirmó la capacidad de los aislados de quebrar la resistencia conferida por el gen Tsw en pimiento, caracterizándolos como aislados RB (resistance-breaking). Estos aislados RB, además, tienen la capacidad de infectar pimientos Tsw- y tomates Sw-5b-, no infectando tomates Sw-5b+.
.
- Autor: Long Island Horticultural Research & Extension Center, Cornell University
.
- Autor: Zachariah Hansen
- Autor: Zachariah Hansen
- Autor: Zachariah Hansen
.
- Autor: @2021 Plant Pathology Department University of Florida
- Autor: @2021 Plant Pathology Department University of Florida
- Autor: @2021 Plant Pathology Department University of Florida
- Autor: @2021 Plant Pathology Department University of Florida
- Autor: @2021 Plant Pathology Department University of Florida
- Autor: @2021 Plant Pathology Department University of Florida
- Autor: @2021 Plant Pathology Department University of Florida
- Autor: @2021 Plant Pathology Department University of Florida
.
- Autor: Ed Sikora
- Autor: Ed Sikora
.
.
.
.
Fotos
TSWV en pimiento, Florida University
.
Bibliografía
Agarwal G, Clevenger J, Kale SM, et al. (2019) A recombination bin-map identified a major QTL for resistance to Tomato Spotted Wilt Virus in peanut (Arachis hypogaea). Sci Rep 9: 18246. doi: 10.1038/s41598-019-54747-1
Bandla MD, Westcot DM, Chenault K, et al. (1994) Use of monoclonal antibody to the nonstructural protein encoded by the small RNA of Tomato spotted wilt tospovirus to identify viruliferous thrips. Phytopathology 84: 1427–1431. doi: 10.1094/Phyto-84-1427
Bandla MD, Campbell LR, Ullman DE, Sherwood JL (1998) Interaction of Tomato spotted wilt tospovirus (TSWV) glycoproteins with a thrips midgut protein, a potential cellular receptor for TSWV. Phytopathology 88: 98–104. doi: 10.1094/PHYTO.1998.88.2.98
Best RJ (1968) Tomato Spotted Wilt Virus. Advances in Virus Research 13: 65-146. doi: 10.1016/S0065-3527(08)60251-1
Chen G, Su Q, Shi X, et al. (2018) Persistently Transmitted Viruses Restrict the Transmission of Other Viruses by Affecting Their Vectors. Front. Physiol. 9: 1261. doi: 10.3389/fphys.2018.01261
Chen Z, Wu Q, Tong C, et al. (2021) Characterization of the Roles of SGT1/RAR1, EDS1/NDR1, NPR1, and NRC/ADR1/NRG1 in Sw-5b-Mediated Resistance to Tomato Spotted Wilt Virus. Viruses 13(8): 1447. doi: 10.3390/v13081447
Chen J, Zhao Y, Luo X, et al. (2022) NLR surveillance of pathogen interference with hormone receptors induces immunity. Nature. doi: 10.1038/s41586-022-05529-9
Crescenzi A, Viggiano A, Fanigliulo A (2013) Resistance breaking tomato spotted wilt virus isolates on resistant pepper varieties in Italy. Commun Agric Appl Biol Sci. 78(3): 609-12. PMID: 25151838
de Assis Filho FM, Naidu RA, Deom CM, Sherwood JL (2002) Dynamics of Tomato spotted wilt virus replication in the alimentary canal of two thrips species. Phytopathology 92: 729–733. doi: 10.1094/PHYTO.2002.92.7.729
de Borbón CM, Gracia O, Píccolo R (2006) Relationships between Tospovirus Incidence and Thrips Populations on Tomato in Mendoza, Argentina. Journal of Phytopathology 154: 93-99. doi: 10.1111/j.1439-0434.2006.01066.x
Debreczeni DE, López C, Aramburu J, et al. (2015) Complete sequence of three different biotypes of tomato spotted wilt virus (wild type, tomato Sw-5 resistance-breaking and pepper Tsw resistance-breaking) from Spain. Arch Virol. 160(8): 2117-23. doi: 10.1007/s00705-015-2453-8
Du J, Song X, Shi X, Tang X, Chen J, Zhang Z, Chen G, Zhang Z, Zhou X, Liu Y and Zhang D (2020) NSs, the Silencing Suppressor of Tomato Spotted Wilt Orthotospovirus, Interferes With JA-Regulated Host Terpenoids Expression to Attract Frankliniella occidentalis. Front. Microbiol. 11: 590451. doi: 10.3389/fmicb.2020.590451
Ferrand L (2017) Caracterización de aislamientos argentinos de Tomato spotted wilt virus que quiebran la resistencia mediada por el gen Tsw en Capsicum annuum L. Tesis Doctoral, Facultad de Ciencias Agrarias y Forestales, Universidad Nacional de La Plata. Link
Ferrand L, García ML, Resende RO, Balatti PA, Dal Bó E (2015) First Report of a Resistance-breaking Isolate of Tomato spotted wilt virus Infecting Sweet Pepper Harboring the Tsw Gene in Argentina. Plant Disease 99: 12, 1869. doi: 10.1094/PDIS-02-15-0207-PDN
Ferrand L, Almeida MMS, Orílio AF, Dal Bó E, Resende RO, García ML (2019) Biological and molecular characterization of tomato spotted wilt virus (TSWV) resistance‐breaking isolates from Argentina. Plant Pathology 68: 1587-1601. doi: 10.1111/ppa.13087
Fletcher SJ, Shrestha A, Peters JR, et al. (2016) The Tomato Spotted Wilt Virus Genome Is Processed Differentially in its Plant Host Arachis hypogaea and its Thrips Vector Frankliniella fusca. Front. Plant Sci. 7: 1349. doi: 10.3389/fpls.2016.01349
Jones S, Baizan-Edge A, MacFarlane S and Torrance L (2017) Viral Diagnostics in Plants Using Next Generation Sequencing: Computational Analysis in Practice. Frontiers in Plant Science 8: 1770. doi: 10.3389/fpls.2017.01770
Kikkert M, Meurs C, van de Wetering F, et al. (1998) Binding of Tomato Spotted Wilt Virus to a 94-kDa Thrips Protein. Phytopathology 88(1): 63-9. doi: 10.1094/PHYTO.1998.88.1.63
Kim SB, Kang WH, Huy HN, Yeom SI, An JT, Kim S, Kang MY, Kim HJ, Jo YD, Ha Y, Choi D, Kang BC (2017) Divergent evolution of multiple virus-resistance genes from a progenitor in Capsicum spp. New Phytologist 13(2):886-899. doi: 10.1111/nph.14177
Kritzman A, Gera A, Raccah B, et al. (2002) The route of Tomato spotted wilt virus inside the thrips body in relation to transmission efficiency. Arch. Virol. 147: 2143–2156. doi: 10.1007/s00705-002-0871-x
Linak JA, Jacobson AL, Sit TL et al. (2020) Relationships of virus titers and transmission rates among sympatric and allopatric virus isolates and thrips vectors support local adaptation. Sci Rep 10: 7649. doi: 10.1038/s41598-020-64507-1
Martin KM, Chen Y, Mayfield MA, et al. (2024) Visualizing tomato spotted wilt virus protein localization: Cross-kingdom comparisons of protein-protein interactions. Molecular Plant-Microbe Interactions 38(1):84-96. doi: 10.1094/MPMI-09-24-0108-R
Montero-Astua M, Rotenberg D, Leach-Kieffaber A, et al. (2014) Disruption of vector transmission by a plant-expressed viral glycoprotein. Mol. Plant-Microbe Interact. 27: 296-304. doi: 10.1094/MPMI-09-13-0287-FI
Montero-Astúa M, Ullman DE, Whitfield AE (2016) Salivary gland morphology, tissue tropism and the progression of tospovirus infection in Frankliniella occidentalis. Virology 493: 39-51. doi: 10.1016/j.virol.2016.03.003
Montero-Astúa M, Stafford-Banks CA, Badillo-Vargas IE, et al. (2016) CHAPTER 20: Tospovirus–Thrips Biology. Vector-Mediated Transmission of Plant Pathogens. pp. 289-308. doi: 10.1094/9780890545355.020
Moritz G, Kumm S, Mound L (2004) Tospovirus transmission depends on thrips ontogeny. Virus Research 100: 143-149. doi: 10.1016/j.virusres.2003.12.022
Nagata T, Inoue-Nagata AK, Smid HM, et al. (1999) Tissue tropism related to vector competence of Frankliniella occidentalis for Tomato spotted wilt tospovirus. J. Gen. Virol. 80: 507–515. doi:
Nagata T, Inoue-Nagata AK, Prins M, et al. (2000). Impeded thrips transmission of defective Tomato spotted wilt virus isolates. Phytopathology 90: 454–459. doi: 10.1094/PHYTO.2000.90.5.454
Nagata T, Inoue-Nagata A, van Lent J, Goldbach R, Peters D (2002) Factors determining vector competence and specificity for transmission of Tomato spotted wilt virus. J. Gen. Virol. 83: 663-671. doi:
Nachappa P, Challacombe J, Margolies DC, Nechols JR, Whitfield AE and Rotenberg D (2020) Tomato Spotted Wilt Virus Benefits Its Thrips Vector by Modulating Metabolic and Plant Defense Pathways in Tomato. Front. Plant Sci. 11: 575564. doi: 10.3389/fpls.2020.575564
Nicaise V (2014) Crop immunity against viruses: outcomes and future challenges. Frontiers in Plant Science 5: 660. doi: 10.3389/fpls.2014.00660
Nilon A, Robinson K, Pappu HR, Mitter N (2021) Current Status and Potential of RNA Interference for the Management of Tomato Spotted Wilt Virus and Thrips Vectors. Pathogens 10(3): 320. doi: 10.3390/pathogens10030320
Padmanabhan C, Ma Q, Shekasteband R, et al. (2019) Comprehensive transcriptome analysis and functional characterization of PR-5 for its involvement in tomato Sw-7 resistance to tomato spotted wilt tospovirus. Sci Rep 9: 7673. doi: 10.1038/s41598-019-44100-x
Pennazio S, Roggero P, Conti M (1996) Yield losses in virus‐infected crops. Archives of Phytopathology and Plant Protection 30: 283-296. doi: 10.1080/03235409609383178
Roggero et al. Resistance to tospoviruses in pepper. Thrips and tospoviruses: proceedings of the 7th international symposium on Thysanoptera, pp. 105-110. Link
Ruark-Seward CL, Bonville B, Kennedy G, et al. (2020) Evolutionary dynamics of Tomato spotted wilt virus within and between alternate plant hosts and thrips. Sci Rep 10: 15797. doi: 10.1038/s41598-020-72691-3
Salvalaggio A, López Lambertini P, Cendoya G, Huarte M (2017) Pautas para el manejo de “Top necrosis” en el cultivo de papa. EEA Balcarce-INTA. LINK
Schneweis DJ, Whitfield AE, Rotenberg D (2017) Thrips developmental stage-specific transcriptome response to tomato spotted wilt virus during the virus infection cycle in Frankliniella occidentalis, the primary vector. Virology 500: 226-237. doi: 10.1016/j.virol.2016.10.009
Scholthof KBG et al. (2011) Top 10 plant viruses in molecular plant pathology. Molecular Plant Pathology 12: 938-954. doi: 10.1111/j.1364-3703.2011.00752.x
Sharman M, Persley DM (2006) Field isolates of Tomato spotted wilt virus overcoming resistance in capsicum in Australia. Australasian Plant Pathology 35: 123–128 (2006). doi: 10.1071/AP06014
Srinivasan R, Abney MR, Culbreath AK, et al.(2017) Three decades of managing Tomato spotted wilt virus in peanut in southeastern United States. Virus Research 241: 203-212. doi: 10.1016/j.virusres.2017.05.016
Tabein S, Jansen M, Noris E, et al. (2020) The Induction of an Effective dsRNA-Mediated Resistance Against Tomato Spotted Wilt Virus by Exogenous Application of Double-Stranded RNA Largely Depends on the Selection of the Viral RNA Target Region. Front. Plant Sci. 11: 533338. doi: 10.3389/fpls.2020.533338
Turina M, Kormelink R, Resende RO (2016) Resistance to Tospoviruses in Vegetable Crops: Epidemiological and Molecular Aspects. Annu Rev Phytopathol. 54: 347-71. doi: 10.1146/annurev-phyto-080615-095843
Ullman D, German T, Sherwood J, Westcot D, Cantone F (1993) Tospovirus replication in insect vector cells – immunocytochemical evidence that the nonstructural protein encoded by the S-RNA of Tomato spotted wilt tospovirus is present in thrips vector cells. Phytopathology 83: 456-463. doi: 10.1094/Phyto-83-456
Ullman DE, Westcot DM, Hunter WB, Mau RFL (1989) Internal anatomy and morphology of Frankliniella occidentalis (Pergande) (Thysanoptera: Thripidae) with special reference to interactions between thrips and Tomato spotted wilt virus. Int. J. Insect Morphol. Embryol. 18: 289–310. doi: 10.1016/0020-7322(89)90011-1
Ullman D, Westcot D, Chenault K, et al. (1995) Compartmentalization, intracellular-transport, and autophagy of tomato spotted wilt tospovirus proteins in infected thrips cells. Phytopathology 85: 644-654. doi: 10.1094/Phyto-85-644
van de Wetering F, Peters D, Golbach R (1996) TSWV is transmitted by Frankliniella occidentalis only after acquisition during the first larval stage. Acta Horticulturae 431: 350-358. doi: 10.17660/ActaHortic.1996.431.30
van de Wetering F, Golbach R, Peters D (1996) Tomato spotted wilt Tospovirus ingestion by first larval instar of Frankliniella occidentalis is a prerequisite for transmission. Phytopathology 86: 900-905. doi: 10.1094/Phyto-86-900
van de Wetering F, van der Hoek M, Goldbach R, Peters D (1999) Differences in tomato spotted wilt virus vector competency between males and females of Frankliniella occidentalis. Entomologia Experimentalis et Applicata 93: 105-112. doi: 10.1046/j.1570-7458.1999.00567.x
Wagemans J, Holtappels D, Vainio E, et al. (2022) Going Viral: Virus-Based Biological Control Agents for Plant Protection. Annu Rev Phytopathol. 60: 21-42. doi: 10.1146/annurev-phyto-021621-114208
Wijkamp I, van Lent J, Komerlink R, et al. (1993) Multiplication of tomato spotted wilt virus in its insect vector, Frankliniella occidentalis. J. Gen. Virol. 74: 342-349. doi:
Wijkamp I, Almarza N, Goldbach R, Peters D (1995) Distinct levels of specificity in thrips transmission of tospoviruses. Phytopathology 85: 1069-1074. doi: 10.1094/Phyto-85-1069
Whitfield AE, Ullman DE, German TL (2004) Expression and characterization of a soluble form of Tomato spotted wilt virus glycoprotein GN. J. Virol. 78: 13197–13206. doi: 10.1128/JVI.78.23.13197-13206.2004
Whitfield A, Ullman D, German T (2005) Tospovirus-thrips interactions. Annu. Rev. Phytopathol., 43: 459-489. doi: 10.1146/annurev.phyto.43.040204.140017
Zhan J, Shi H, Li W, Zhang C, Zhang Y (2021) NbTMP14 Is Involved in Tomato Spotted Wilt Virus Infection and Symptom Development by Interaction with the Viral NSm Protein. Viruses 13(3): 427. doi: 10.3390/v13030427
(2023) TOM1 family conservation within the plant kingdom for tobacco mosaic virus accumulation. Molecular Plant Pathology 00: 1– 15. doi: 10.1111/mpp.13375
Zhao L, Hu Z, Li S, et al. (2019) Diterpenoid compounds from Wedelia trilobata induce resistance to Tomato spotted wilt virus via the JA signal pathway in tobacco plants. Sci Rep 9: 2763.