.
Condición fitosanitaria: Presente
Grupo de cultivos: Cereales
Especie hospedante: Trigo (Triticum aestivum)
Rango de hospedantes: trigo, cebada
Epidemiología: policíclica, subaguda.
Etiología: Hongo. Hemibiotrófico
Agente causal: Parastagonospora nodorum
[teleomorph: Phaeosphaeria (Hedjar.), syn. Leptosphaeria nodorum (Müll.), syn. Septoria nodorum (Berk.), syn. Stagonospora nodorum (Berk.)]
.
Taxonomía: Eukaryota > Fungi > Dikarya > Ascomycota > Pezizomycotina > Dothideomycetes > Pleosporales > Phaeosphaeriaceae > Parastagonospora
.
.
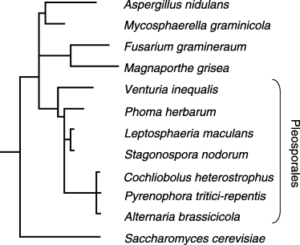
- Resumen de la ubicación taxonómica de Stagonospora nodorum (Parastagonospora nodorum). Autor: Solomon et al., 2006, adaptado de Goodwin 2004.
.
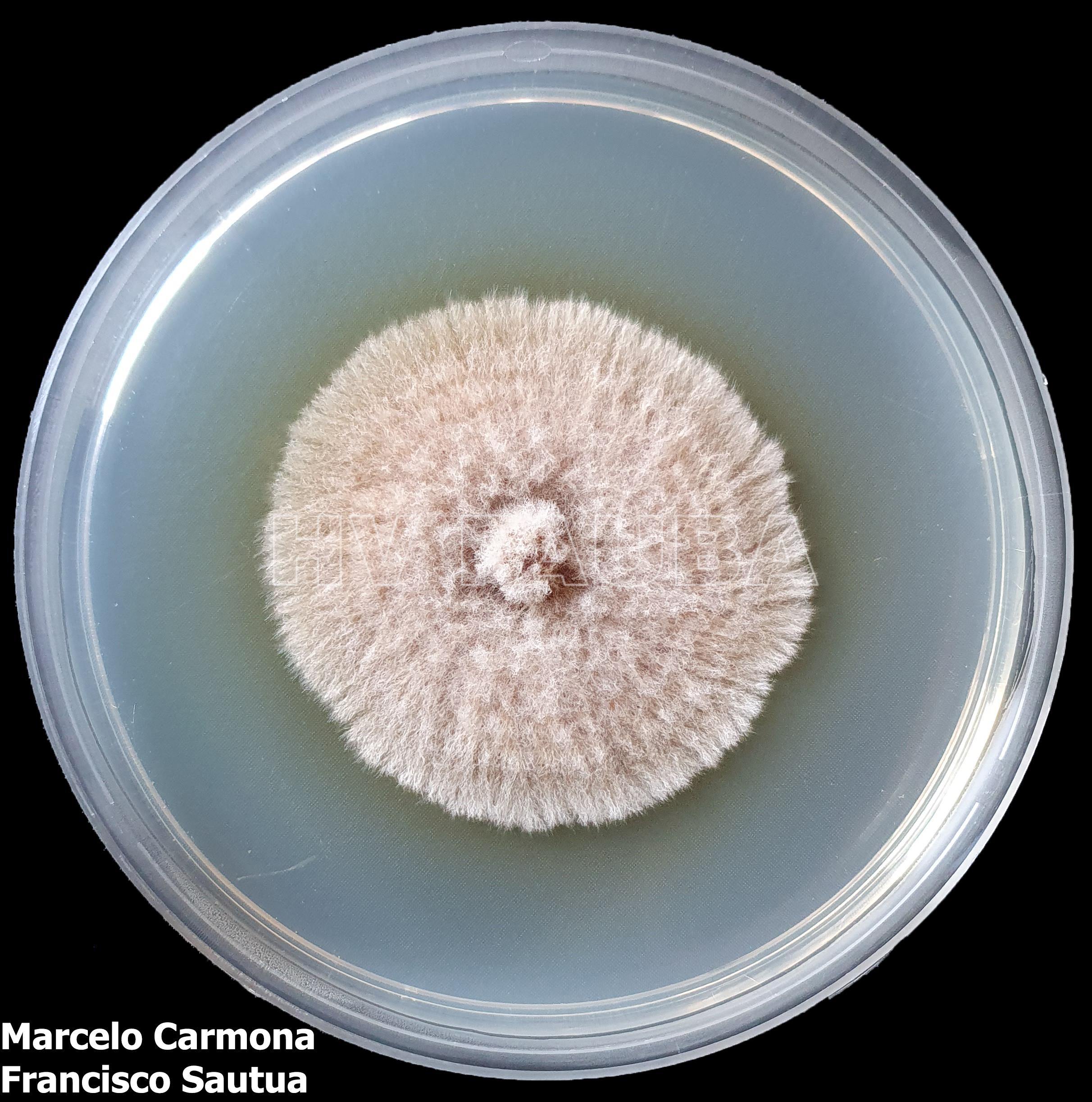
- Colonia de 7 días de Parastagonospora nodorum en APD.
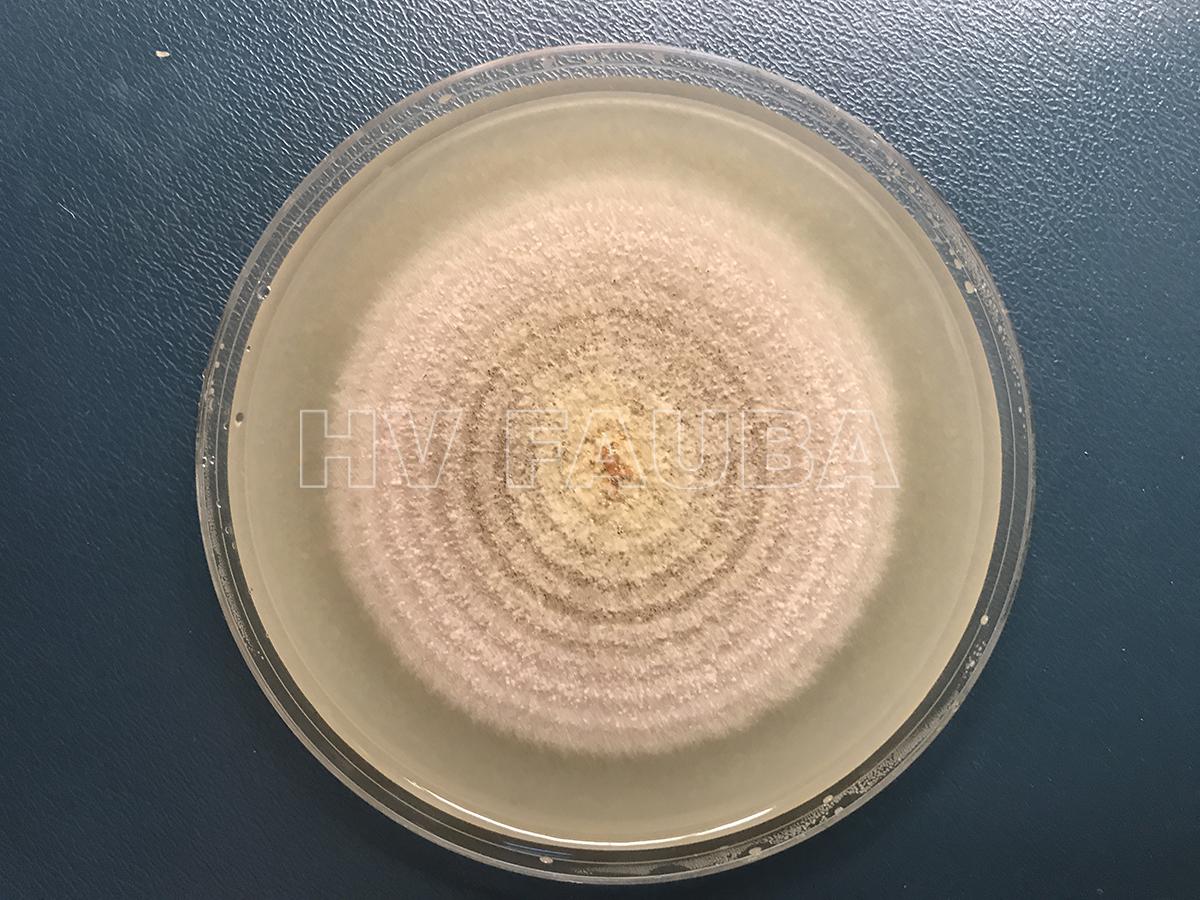
- Colonia de 7 días de Parastagonospora nodorum en V8. Autor: U. Adhikari, publicado en Mehra et al., 2009.
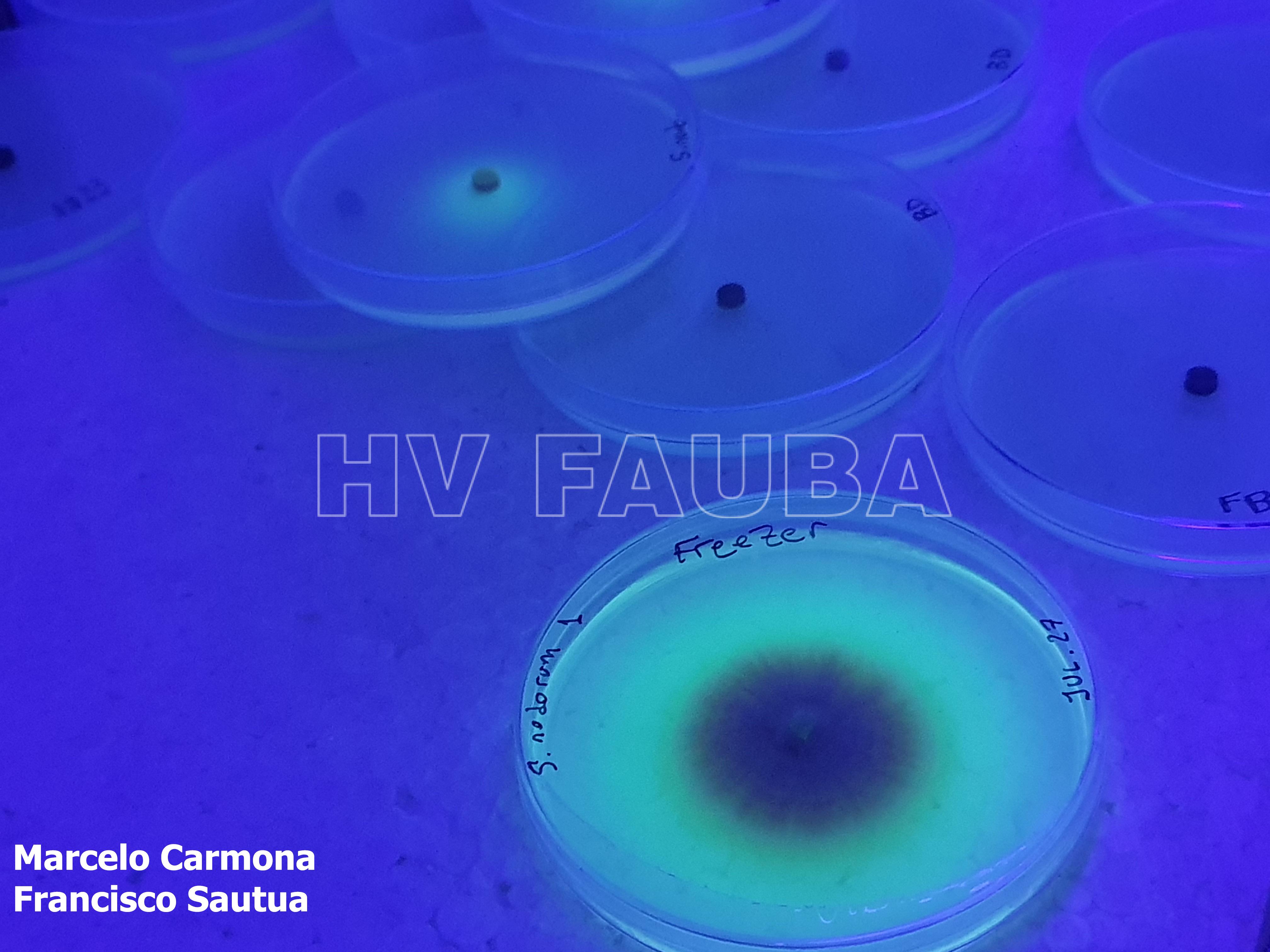
- Fluorescencia de colonia de Parastagonospora nodorum
- Fluorescencia de colonia de Parastagonospora nodorum
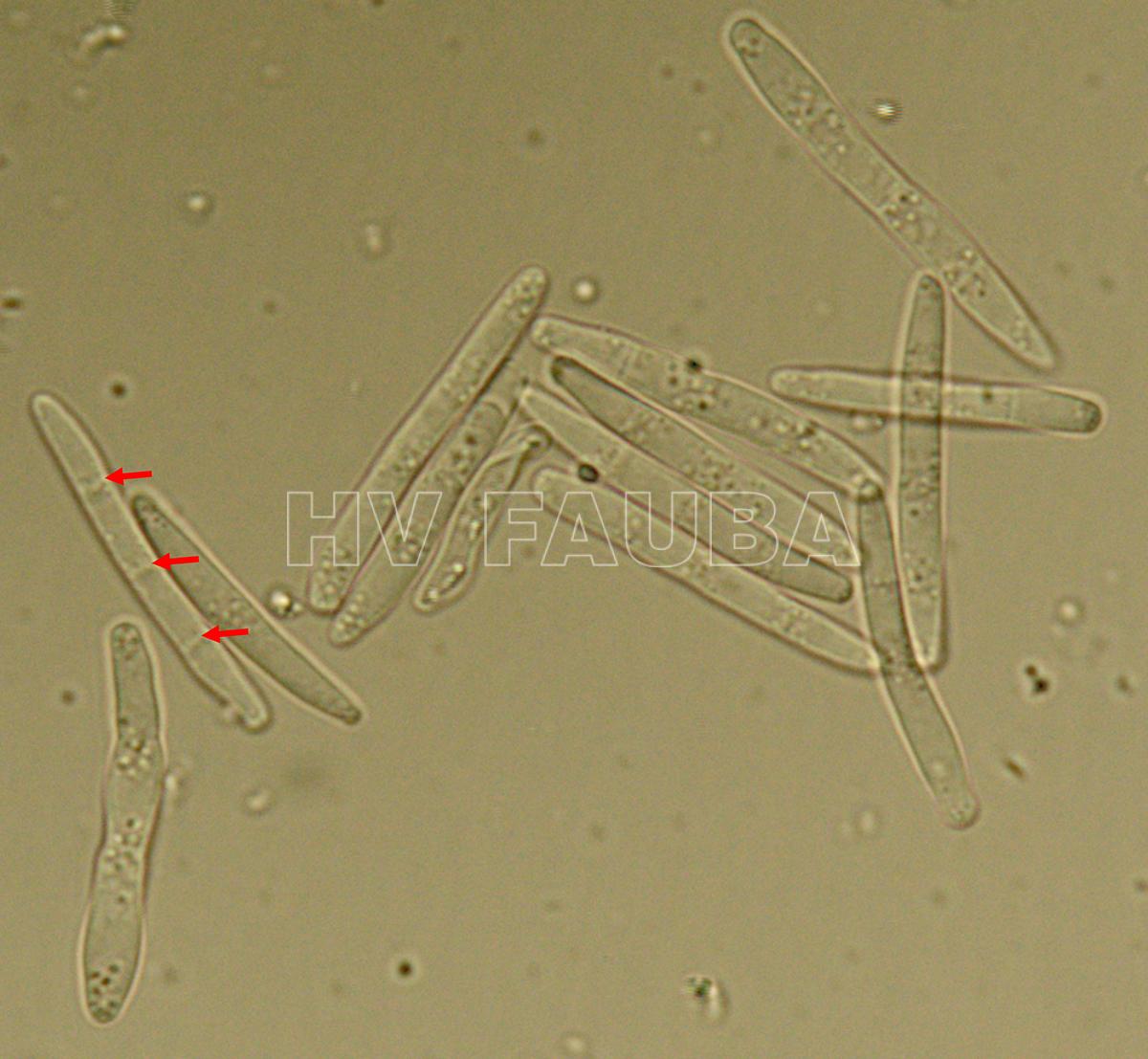
- Conidios de Parastagonospora nodorum. Las flechas blancas indican tres tabiques de un conidio a 1000 ×. Autor:: U. Adhikari, publicado en Mehra et al., 2009.
.
.
.
Antecedentes
El mancha de la gluma y del nudo del trigo (MGNT) es una enfermedad prevalente en regiones productoras de trigo con precipitaciones relativamente altas o periódicamente altas, como regiones de Australia, Canadá, Escandinavia, Europa central y oriental, este de EE. UU. Y América del Sur. En Argentina es una enfermedad de reciente reemergencia (Erreguerena et al., 2019).
.
Síntomas
El patógeno causa clorosis y necrosis del tejido de la hoja del trigo (a menudo en forma de lesiones necróticas rodeadas de clorosis, que luego se convierten en lesiones irregulares de color marrón oscuro), así como decoloración y necrosis de las glumas, denominadas mancha foliar y mancha de gluma, respectivamente (Solomon et al., 2006). La mancha foliar reduce la superficie fotosintética de la planta , lo que limita el crecimiento y el rendimiento general del cultivo, mientras que la mancha de la gluma afecta directamente la calidad del grano. Debido a tales daños, se sabe que la MGNT causa pérdidas de rendimiento de hasta ~ 30% (Bhathal et al., 2003). En la práctica, la enfermedad a menudo se presenta en combinación con otras enfermedades fúngicas necrotróficas como la mancha por Septoria (causada por Zymoseptoria tritici) y la mancha amarilla (causada por Pyrenophora tritici-repentis). Cuando ocurren tales complejos de enfermedades, a menudo puede ser difícil determinar visualmente qué enfermedades necrotróficas están presentes. Sin embargo, los ensayos moleculares (qPCR) para P. nodorum (Oliver et al., 2008), Z. tritici (Bearchell et al., 2005) y P. tritici-repentis (Antoni et al. 2010) ayudan a distinguir los agentes causales de las coinfecciones de trigo. Además, se ha desarrollado una prueba ITS-RFLP que distingue entre patógenos necrotróficos, incluidos P. nodorum y P. tritici-repentis (Hafez et al. 2020).
.
- Síntomas de tizón foliar (A) y manchado de gluma y nudo (B) en trigo, causados por Parastagonospora nodorum. Autor: Downie et al., 2020.
.
.
Ciclo de la enfermedad y epidemiología
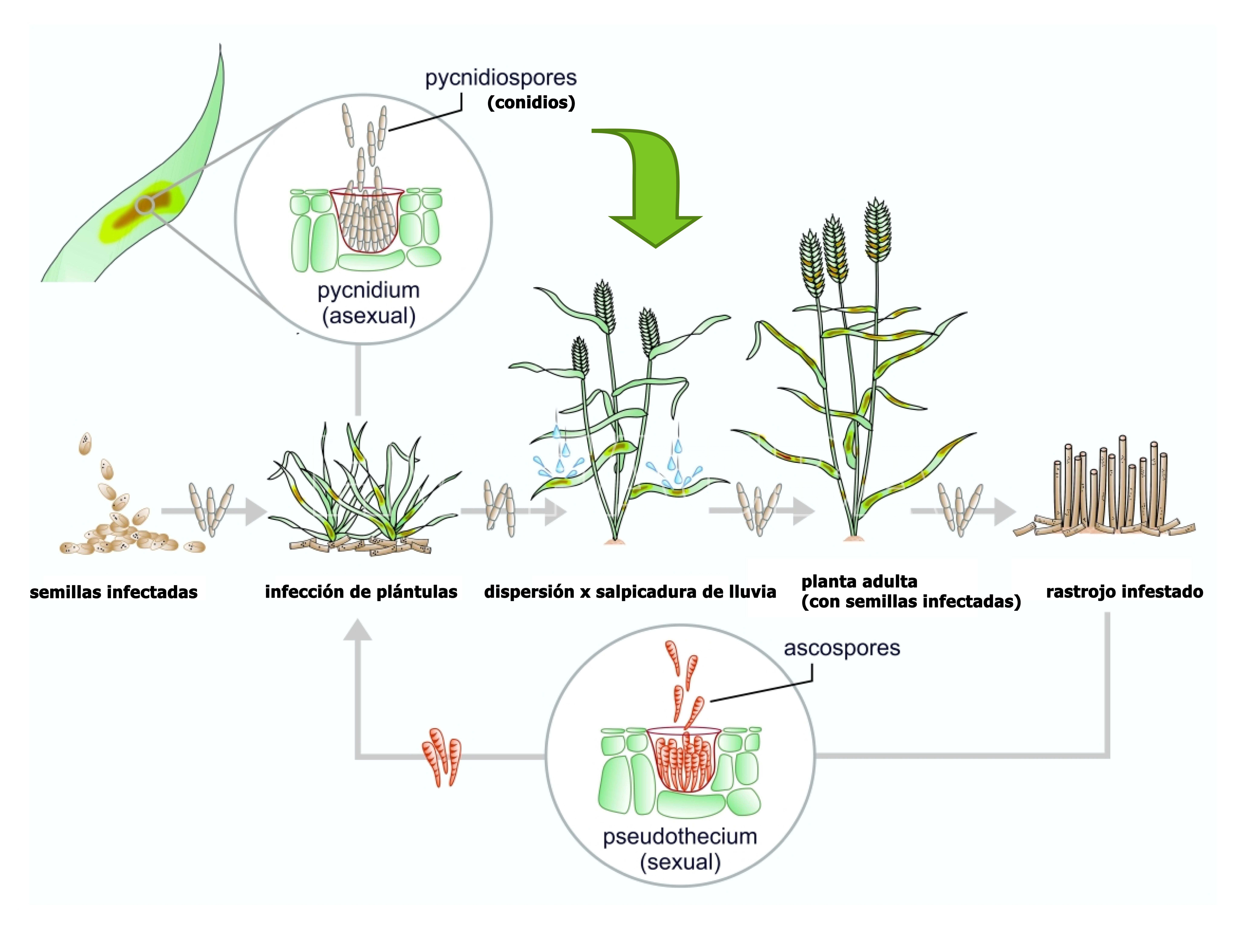
La principal fuente de inóculo es el rastrojo infectado (principalmente con picnidios). La diseminación a través de semillas infectadas ha sido reportada solamente en E.E.U.U. (Bennett et al., 2007), pero no en otras partes productoras de trigo.
- Ciclo de la mancha de la gluma y el nudo por Septoria nodorum (Parastagonospora nodorum). Autor: Downie et al., 2020.
.
Manejo Integrado
La principal medida preferencial es la siembra de variedades resistentes, si hubiera disponibles; y en segundo lugar la rotación de cultivos.
* Rotación de cultivos: El trigo debería ser cultivado en el mismo lote, sólo después de la completa mineralización de los restos culturales. Rotaciones con colza, lino y avena podrían resultar exitosas para el manejo de la enfermedad.
Otras:
* Aplicación de fungicidas foliares: Esta práctica es recomendada en cultivos donde la enfermedad ya está presente alcanzando un nivel de daño que justifique el control químico.
* Eliminación de plantas guachas: Tales plantas garantizan la supervivencia del patógeno en el verano‑otoño, actuando como puentes «verdes» y comprometiendo el período de rotación necesario.
* Resistencia varietal: La mayoría de los cultivares de trigo son susceptibles en diversos grados, aunque existen algunos genotipos de trigo que tienen mejor comportamiento.
* Siembra de mezclas de cultivares con diferente nivel de resistencia: en Túnez la inclusión de un cultivar resistente a enfermedades en una proporción del 25% con un cultivar susceptible proporcionó una reducción sustancial de casi el 50% en la gravedad de la Mancha salpicada o Septoriosis de la hoja del trigo (causada por Zymoseptoria tritici) en comparación con el rodal puro susceptible (Ben et al., 2020).
.
.
.
.
.
Bibliografía
Aboukhaddour R, Hafez Abdel-Fattah M, McDonald M, et al. (2023) A revised nomenclature for ToxA haplotypes across multiple fungal species. Phytopathology. doi: 10.1094/PHYTO-01-23-0017-SC
Andersson B, Djurle A, Ørum JE, et al. (2022) Comparison of models for leaf blotch disease management in wheat based on historical yield and weather data in the Nordic-Baltic region. Agron. Sustain. Dev. 42: 42. doi: 10.1007/s13593-022-00767-7
Antoni EA, Rybak K, Tucker MP, Hane JK, Solomon PS, Drenth A, Shankar M, Oliver RP (2010). Ubiquity of ToxA and absence of ToxB in Australian populations of Pyrenophora tritici-repentis. Australas Plant Pathology 39: 63-68. doi: 10.1071/AP09056
Bearchell SJ, Fraaije BA, Shaw MW, Fitt BDL (2005) Wheat archive links long-term fungal pathogen population dynamics to air pollution. Proc Natl Acad Sci USA 102: 5438–5442. doi: 10.1073/pnas.0501596102
Bennett RS, Milgroom MG, Sainudiin R, Cunfer BM, Bergstrom GC (2007) Relative contribution of seed-transmitted inoculum to foliar populations of Phaeosphaeria nodorum. Phytopathology, 97: 584-591. doi: 10.1094/PHYTO-97-5-0584
Bhathal JS, Loughman R, Speijers J (2003). Yield reduction in wheat in relation to leaf disease from yellow (tan) spot and septoria nodorum blotch. Eur J Plant Pathol 109: 435–443. doi: 10.1023/A:1024277420773
Choupannejad R, Sharifnabi B, Collemare J, et al. (2023) Host susceptibility and fungal virulence in the wheat-Parastagonospora nodorum interactions. PREPRINT (Version 1) available at Research Square. doi: 10.21203/rs.3.rs-3198290/v1
Dagvadorj B, Outram MA, Williams SJ, Solomon PS (2022) The necrotrophic effector ToxA from Parastagonospora nodorum interacts with wheat NHL proteins to facilitate Tsn1-mediated necrosis. Plant J 110: 407-418. doi: 10.1111/tpj.15677
Downie RC, Lin M, Corsi B, et al. (2020) Septoria nodorum blotch of wheat: disease management and resistance breeding in the face of shifting disease dynamics and a changing environment. Phytopathology. doi: 10.1094/PHYTO-07-20-0280-RVW
Erreguerena I, Carpaneto B, Samoiloff A, Couretot L (2019) Parastagonospora nodorum: un patógeno re-emergente en trigo y ahora también en cebada. INTA
Friesen TL, Stukenbrock EH, Liu Z, et al. (2006) Emergence of a new disease as a result of interspecific virulence gene transfer. Nature Genetics 38: 953–956. doi: 10.1038/ng1839
Friesen TL, Faris JD, Solomon PS, Oliver RP (2008) Host-specific toxins: effectors of necrotrophic pathogenicity. Cell Microbiol. 10(7): 1421-8. doi: 10.1111/j.1462-5822.2008.01153.x
Gao Y, Faris JD, Liu Z, et al. (2015) Identification and Characterization of the SnTox6-Snn6 Interaction in the Parastagonospora nodorum-Wheat Pathosystem. Mol Plant Microbe Interact. 28(5): 615-25. doi: 10.1094/MPMI-12-14-0396-R
Ghaderi F, Sharifnabi B, Javan‐Nikkhah M, et al. (2020) SnToxA, SnTox1, and SnTox3 originated in Parastagonospora nodorum in the Fertile Crescent. Plant Pathology 69(8): 1482-1491. doi: 10.1111/ppa.13233
Hafez M, Gourlie R, Despins T, et al. (2020) Parastagonospora nodorum and Related Species in Western Canada: Genetic Variability and Effector Genes. Phytopathology 110(12): 1946-1958. doi: 10.1094/PHYTO-05-20-0207-R
, , , et al. (2022) Chromatin-immunoprecipitation reveals the PnPf2 transcriptional network controlling effector-mediated virulence in a fungal pathogen of wheat. bioRxiv 2022.06.16.496517; doi: 10.1101/2022.06.16.496517
Kanyuka K, Igna AA, Solomon PS, Oliver RP (2021) The rise of necrotrophic effectors. New Phytol. doi: 10.1111/nph.17811
Kariyawasam GK, Richards JK, Wyatt NA, et al. (2021) The Parastagonospora nodorum necrotrophic effector SnTox5 targets the wheat gene Snn5 and facilitates entry into the leaf mesophyll. New Phytol. doi: https://doi.org/10.1111/nph.17602
Kariyawasam GK, Nelson AC, Williams SJ, et al. (2023) The Necrotrophic Pathogen Parastagonospora nodorum Is a Master Manipulator of Wheat Defense. Mol Plant Microbe Interact. 36(12): 764-773. doi: 10.1094/MPMI-05-23-0067-IRW
Kartashov M, Voinova T, Shcherbakova L, et al. (2022) A Secondary Metabolite Secreted by Penicillium citrinum Is Able to Enhance Parastagonospora nodorum Sensitivity to Tebuconazole and Azoxystrobin. Front. Fungal Biol. 3: 889547. doi: 10.3389/ffunb.2022.889547
Kaur N, Mullins C, Kleczewski NM, Mehl HL (2021) Occurrence of Quinone Outside Inhibitor Resistance in Virginia Populations of Parastagonospora nodorum Infecting Wheat. Plant Disease 105(6): 1837-1842. doi: 10.1094/PDIS-11-19-2288-RE
Lin M, Ficke A, Cockram J, Lillemo M (2020) Genetic Structure of the Norwegian Parastagonospora nodorum Population. Front. Microbiol. 11: 1280. doi: 10.3389/fmicb.2020.01280
McDonald MC, Oliver RP, Friesen TL, et al. (2013), Global diversity and distribution of three necrotrophic effectors in Phaeosphaeria nodorum and related species. New Phytol, 199: 241-251. doi: 10.1111/nph.12257
Mehra LK, Cowger C, Gross K, Ojiambo PS (2016) Predicting Pre-planting Risk of Stagonospora nodorum blotch in Winter Wheat Using Machine Learning Models. Front. Plant Sci. 7: 390. doi: 10.3389/fpls.2016.00390
Mehra LK, Adhikari U, Ojiambo P S, Cowger C (2019) Septoria nodorum blotch of wheat. The Plant Health Instructor. doi: 10.1094/PHI-I-2019-0514-01
Oliver RP, Rybak K, Shankar M, Loughman R, Harry N, Solomon P (2008) Quantitative disease resistance assessment by real-time PCR using the Stagonospora nodorum-wheat pathosystem as a model. Plant Pathol, 57: 527-532. doi: 10.1111/j.1365-3059.2007.01787.x
Outram MA, Sung Y-C, Yu D, et al. (2021) The crystal structure of SnTox3 from the necrotrophic fungus Parastagonospora nodorum reveals a unique effector fold and provides insight into Snn3 recognition and pro-domain protease processing of fungal effectors. New Phytologist. doi: 10.1111/nph.17516
Pereira DA, McDonald BA, Brunner PC (2017) Mutations in the CYP51 gene reduce DMI sensitivity in Parastagonospora nodorum populations in Europe and China. Pest Manag Sci. 73(7): 1503-1510. doi: 10.1002/ps.4486
Pereira D, McDonald BA, Croll D (2020) The Genetic Architecture of Emerging Fungicide Resistance in Populations of a Global Wheat Pathogen. Genome Biol Evol. 12(12): 2231-2244. doi: 10.1093/gbe/evaa203
Pereira D, Oggenfuss U, McDonald BA, Croll D (2021) Population genomics of transposable element activation in the highly repressive genome of an agricultural pathogen. Microb Genom. 7(8). doi:
Pereira D, Bolton MD, Friesen TL, et al. (2023) Large-scale analyses reveal the contribution of adaptive evolution in pathogenic and non-pathogenic fungal species. bioRxiv 2023.08.28.555124; doi: 10.1101/2023.08.28.555124
Peters Haugrud AR, Shi G, Seneviratne S, et al. (2023) Genome-wide association mapping of resistance to the foliar diseases Septoria nodorum blotch and tan spot in a global winter wheat collection. Mol Breeding 43: 54. doi: 10.1007/s11032-023-01400-5
Phan HTT, Furuki E, Hunziker L, et al. (2021) GWAS analysis reveals distinct pathogenicity profiles of Australian Parastagonospora nodorum isolates and identification of marker-trait-associations to septoria nodorum blotch. Sci Rep 11: 10085. doi: 10.1038/s41598-021-87829-0
Prahl KC, Klink H, Hasler M, et al. (2022) Can Decision Support Systems Help Improve the Sustainable Use of Fungicides in Wheat? Sustainability 14(23): 15599. doi: 10.3390/su142315599
Richards JK, Wyatt NA, Liu Z, et al. (2018) Reference Quality Genome Assemblies of Three Parastagonospora nodorum Isolates Differing in Virulence on Wheat. G3 (Bethesda) 8(2): 393-399. doi: 10.1534/g3.117.300462
Richards JK, Stukenbrock EH, Carpenter J, et al. (2019) Local adaptation drives the diversification of effectors in the fungal wheat pathogen Parastagonospora nodorum in the United States. PLoS Genet. 15(10): e1008223. doi: 10.1371/journal.pgen.1008223
Richards JK, Kariyawasam GK, Seneviratne S, et al. (2021) A triple threat: the Parastagonospora nodorum SnTox267 effector exploits three distinct host genetic factors to cause disease in wheat. New Phytol. doi: 10.1111/nph.17601
Shankar, M, Reeves, K, Bradley, J, et al. (2020) Effect of varietal resistance on the yield loss function of wheat to nodorum blotch. Plant Pathology 00: 1–15. https://doi.org/10.1111/ppa.13317
Shi G, Zhang Z, Friesen TL, et al. (2016) The hijacking of a receptor kinase-driven pathway by a wheat fungal pathogen leads to disease. Sci Adv. 2(10): e1600822. doi: 10.1126/sciadv.1600822
Solomon P, Lowe RGT, Tan K-C, et al. (2006) Stagonospora nodorum: cause of stagonospora nodorum blotch of wheat. Mol Plant Pathol 7: 147–56. doi: 10.1111/j.1364-3703.2006.00326.x
Stukenbrock EH, McDonald BA (2007) Geographical variation and positive diversifying selection in the host‐specific toxin SnToxA. Molecular Plant Pathology 8(3): pp.321-332. doi: 10.1111/j.1364-3703.2007.00396.x
Syme RA, Tan K-C, Hane JK, et al. (2016) Comprehensive Annotation of the Parastagonospora nodorum Reference Genome Using Next-Generation Genomics, Transcriptomics and Proteogenomics. PLoS ONE 11(2): e0147221. doi: 10.1371/journal.pone.0147221
Tan K-C, Phan HTT, Rybak K, et al. (2015) Functional redundancy of necrotrophic effectors – consequences for exploitation for breeding. Front. Plant Sci. 6:501. doi: 10.3389/fpls.2015.00501
White NH, Neves D, Nuckles E, et al. (2022) Identification of Quinone Outside Inhibitor Fungicide-Resistant Isolates of Parastagonospora nodorum from Illinois and Kentucky. Plant Disease. doi: 10.1094/PDIS-01-22-0180-RE