.
Condición fitosanitaria: Presente
Grupo de cultivos: Forestales
Rango de hospedantes: amplio / no específico. P. cinnamomi causa enfermedades en cientos de hospedantes. Es probable que infecte a más de 3000 especies de plantas, incluidas más de 2500 especies nativas de Australia. Zentmyer (1980) enumeró aproximadamente 950 especies hospedantes que incluyen cultivos económicamente importantes como palto, piña, duraznero, castaño y macadamia; plantas hortícolas como rododendro y camelia; y árboles forestales como robles, pinos y eucaliptos. En Australia, P. cinnamomi es un problema no solo en la agricultura y la horticultura, sino que también causa daños generalizados en los ecosistemas naturales en el suroeste de Australia Occidental, Tasmania y Victoria.
Epidemiología: monocíclica, subaguda
Etiología: Pseudohongo. Necrotrófico (hemibiotrófico)
Agente causal: Phytophthora cinnamomi Rands
Taxonomía: Eukaryota > Stramenopiles > Oomycota > Peronosporales > Peronosporaceae > Phytophthora
.
Hasta el momento, se han secuenciado 3 genomas (78 Mb) de tres aislamientos de P. cinnamomi (Phytophthora cinnamomi var cinnamomi v1.0; MP94-48v2; NZFS3750v2); y hay dos análisis publicados de transcriptomas disponibles (Meyer et al., 2016; Reitmann et al., 2016).
.
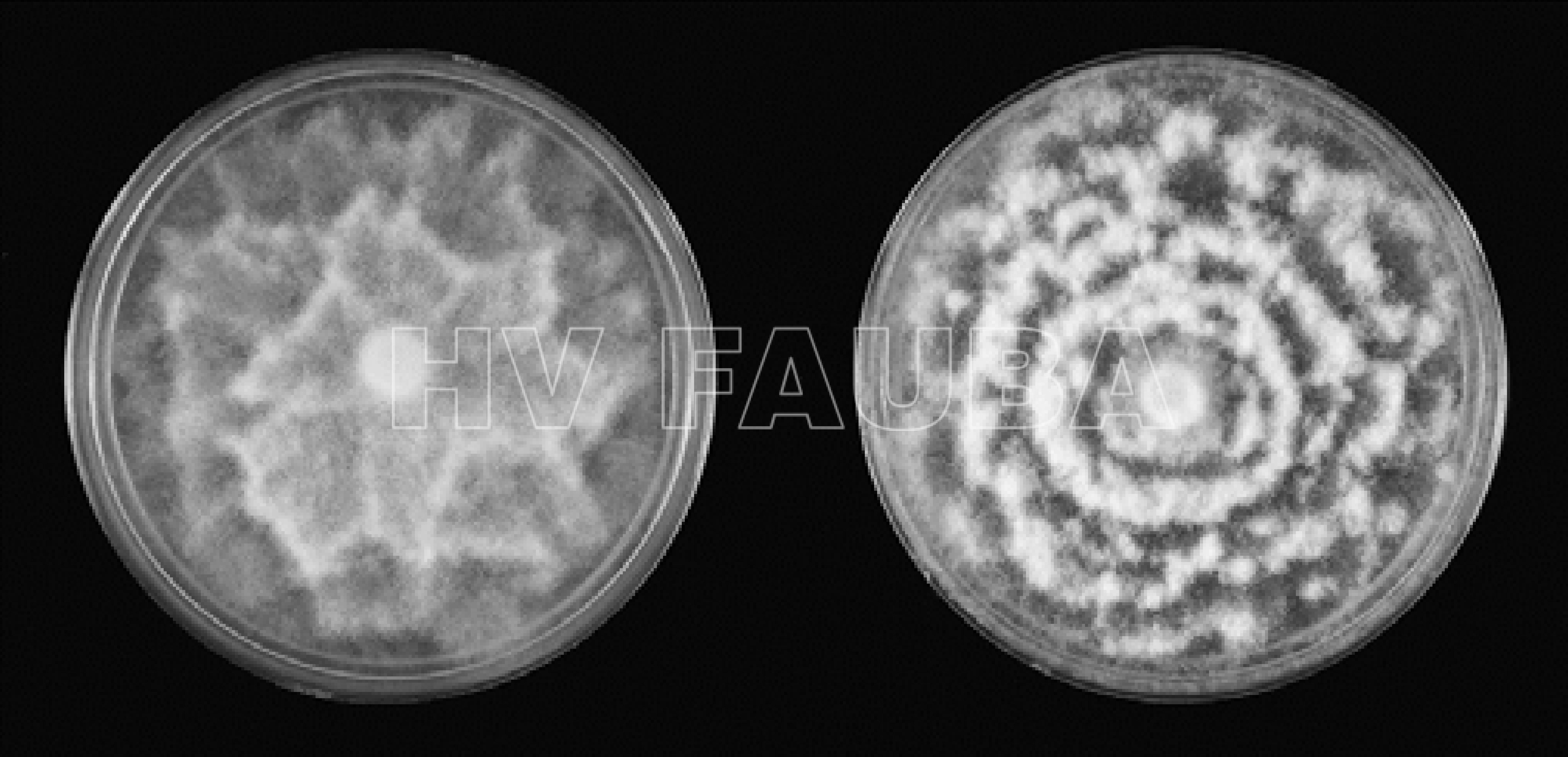
- Aislamiento de Phytophthora cinnamomi que exhibe morfología de colonia estrellada (izquierda) y rosácea (derecha) en agar papa dextrosa. Autor: Eggers et al. 2012
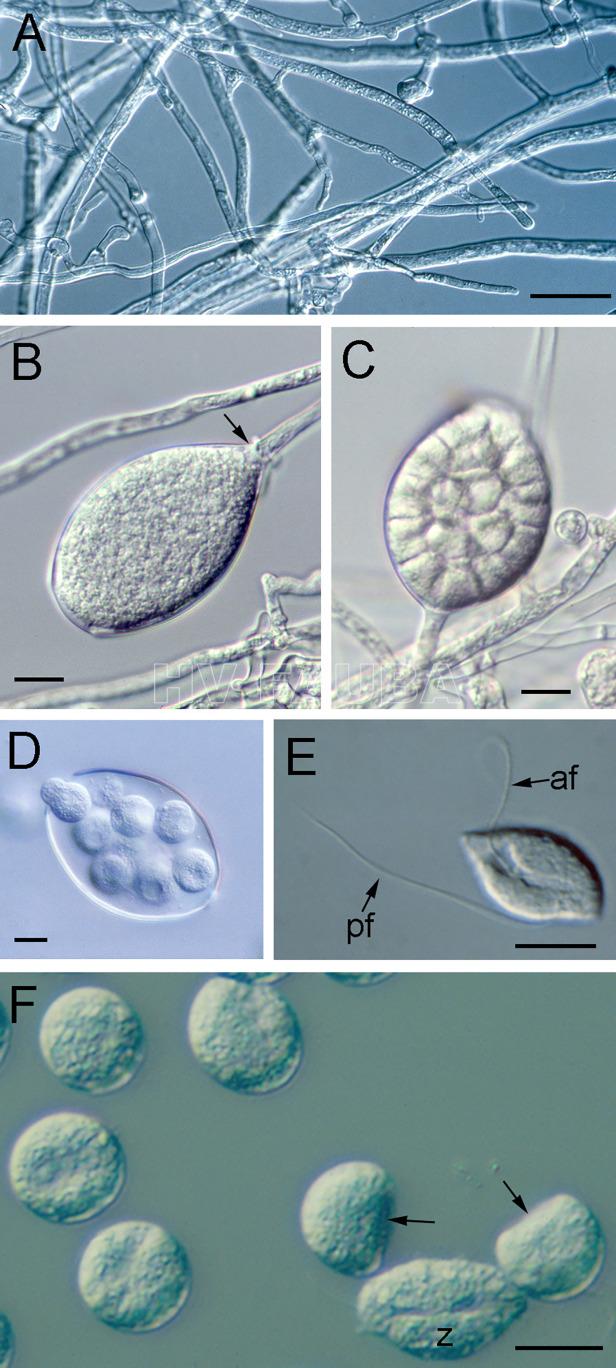
- Estructuras de reproducción asexual de Phytophthora cinnamomi. (A) Hifas vegetativas. (B) Zoosporangio maduro, sin hendir, que está sellado de la hifa subyacente por un tabique (flecha). (C) Zoosporangio escindido en el que se han formado dominios uninucleados mediante el desarrollo de un sistema de membranas de escisión que se convertirán en las membranas plasmáticas de las futuras zoosporas. (D) Liberación de zoosporas de un zoosporangio a través de un poro apical. (E) Una zoospora biflagelada. Los dos flagelos emergen del surco a lo largo de la superficie ventral de la zoospora. El flagelo anterior (af) se proyecta hacia adelante y tira de la célula. El flagelo posterior (pf) se arrastra detrás de la zoospora y funciona para cambiar la dirección de la natación. (F) Una zoospora (z) y seis quistes jóvenes, dos de los cuales aún conservan la región inicialmente plana (flechas) correspondiente a la superficie ventral de la zoospora. Barras, 10 µm. Autor: Hardham y Blackman, 2018
.
.
.
Antecedentes
Phytophthora cinnamomi es uno de los patógenos vegetales más devastadores que se conocen y es una de las especies patógenas más invasoras del mundo, presente en más de 70 países. Esta enfermedad representa una amenaza significativa para la flora australiana, ya que P. cinnamomi mata miles de especies de plantas en ecosistemas naturales en Australia Occidental, amenazando el medio ambiente y la biodiversidad.
P. cinnamomi Rands se aisló por primera vez a partir de árboles de canela (Cinnamomum verum) en Sumatra en 1922. Se cree que el patógeno se originó cerca de Papua Nueva Guinea, pero ahora tiene una distribución mundial.
.
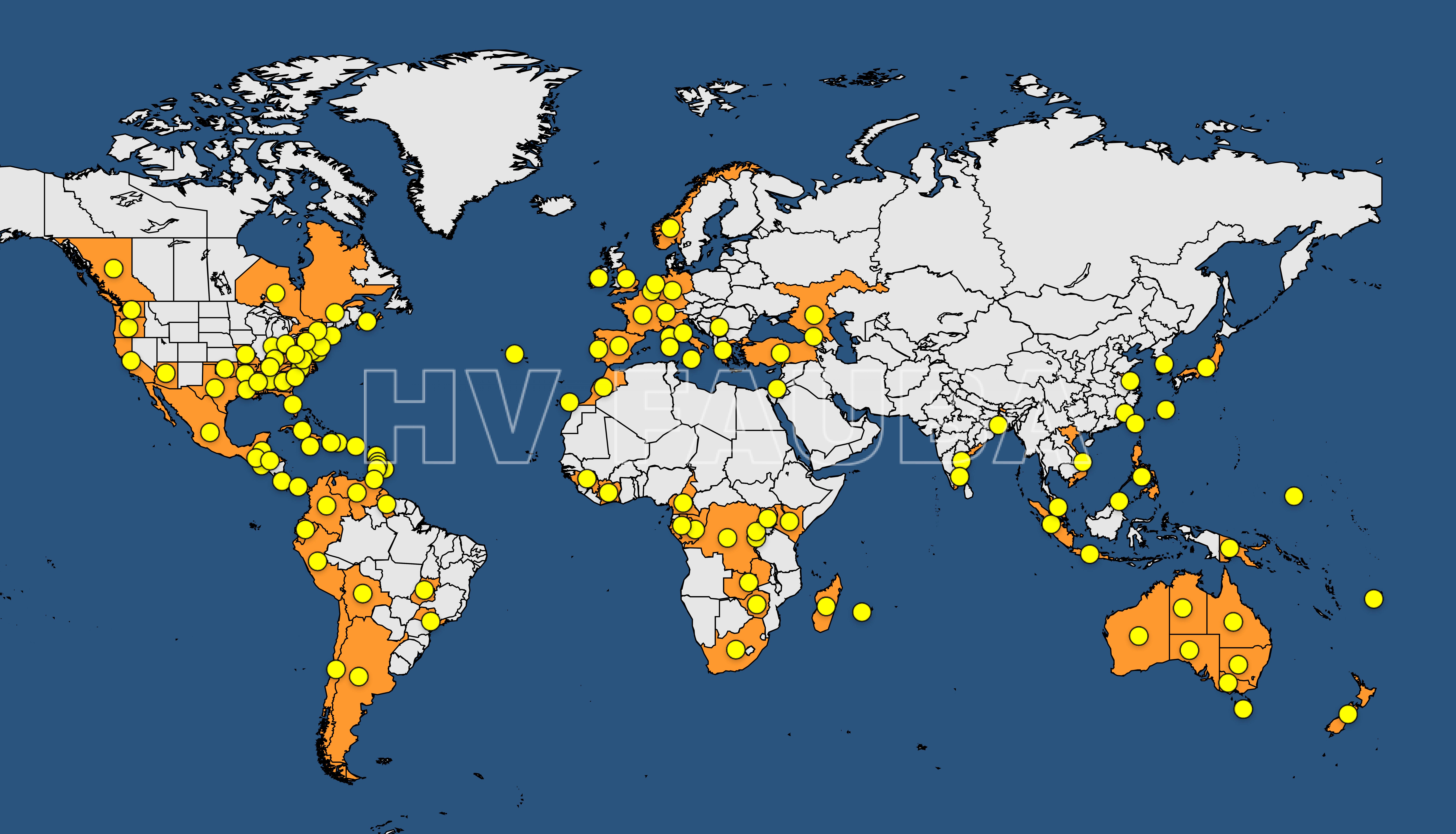
- Distribución mundial de Phytophthora cinnamomi. Fuente: https://gd.eppo.int/taxon/PHYTCN/distribution
.
Síntomas
P. cinnamomi infecta la raíz y generalmente causa la pudrición de raíces finas y fibrosas de plantas leñosas, pero también se ha observado, en algunas especies, que puede causar cancros del tallo. A menudo provoca la muerte regresiva (dieback) de los brotes jóvenes y se cree que lo hace como resultado de la interferencia con la transpiración de las raíces a los brotes.
.
- (A) área no infectada dentro de un bosque de eucaliptos al sur de Perth, Australia, dominada por especies de Eucalyptus marginata, Banksia grandis y Xanthorea (grasstrees). (B) Las especies de Xanthorea y muchas plantas proteáceas en Australia Occidental son altamente susceptibles a P. cinnamomi. Cuando está presente, P. cinnamomi cambia drásticamente la composición floral de la región, con especies más resistentes, como acacias, juncos y juncos, reemplazando las plantas que han sido muertas. Autor: Hardham y Blackman, 2018
.
Diagnóstico
Williams et al. (2009) desarrollaron primers para la detección de P. cinnamomi en suelo.
.
.
Ciclo de la enfermedad
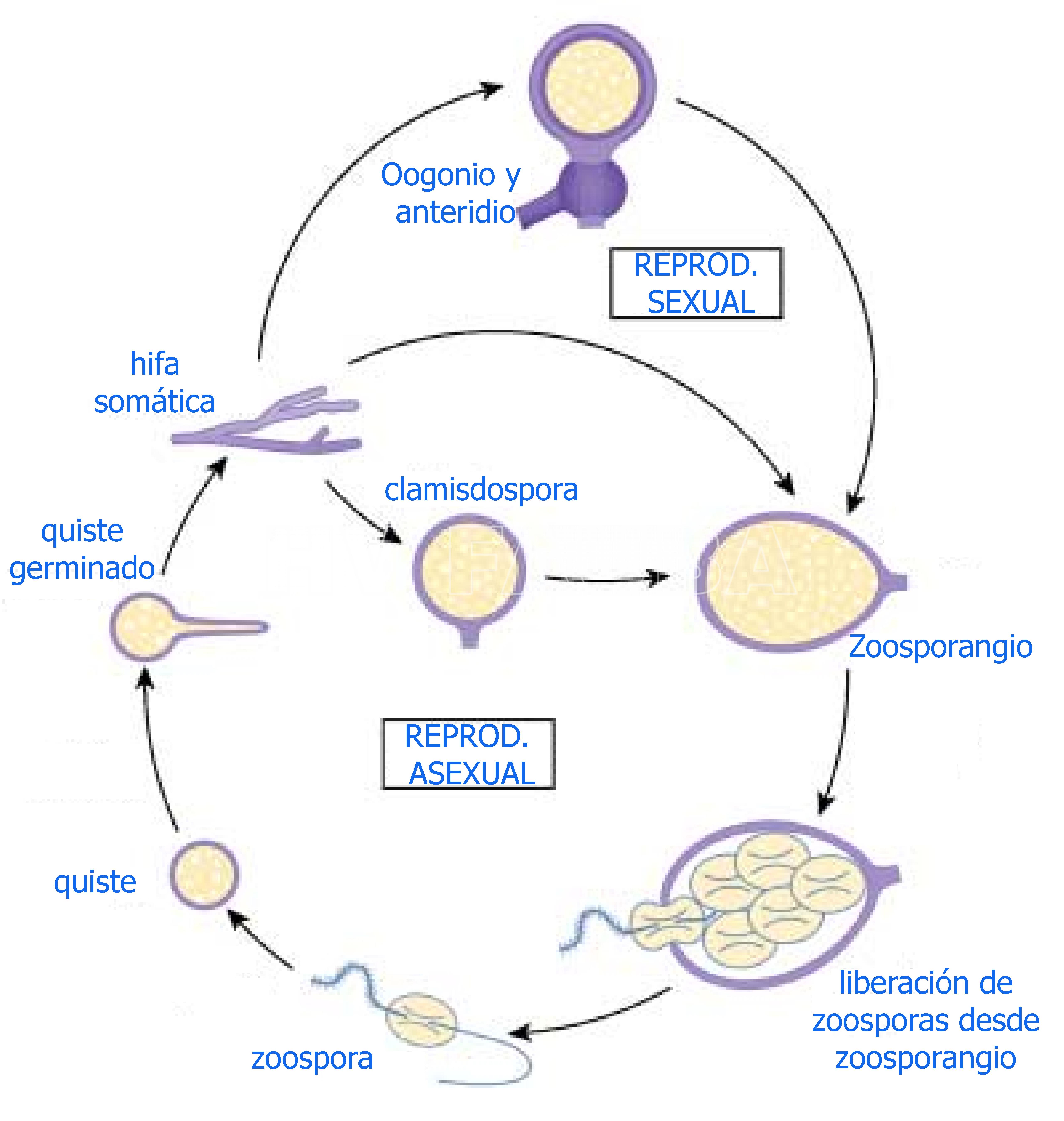
P. cinnamomi puede crecer de forma saprófita en el suelo y persiste en el suelo o material vegetal infectado como clamidosporas y, en menor medida, como oosporas (Weste, 1983; Zentmyer y Mircetich, 1966). Cuando prevalecen las condiciones ambientales favorables para el patógeno, se estimula el ciclo de esporulación asexual. Bajo condiciones óptimas de humedad y temperatura, las clamidosporas germinan para producir zoosporangios, que liberan zoosporas infecciosas. Los niveles freáticos altos y el riego excesivo proporcionan las condiciones adecuadas para aumentar los niveles de inóculo de zoosporas y las subsiguientes infecciones radiculares. Por lo tanto, el exceso de agua en el suelo aumenta la incidencia y la severidad de esta enfermedad. Las hifas somáticas forman zoosporangios multinucleados que escinden y liberan de 20 a 30 zoosporas biflageladas uninucleadas. La quimiotaxis de zoosporas es un aspecto vital del inicio de la enfermedad y el genoma de P. cinnamomi contiene homólogos de tres genes implicados en este proceso en P. infestans y P. sojae, una subunidad α de la proteína G (GPA1), una proteína que interactúa con GPA1 (Hint1) y un GPCR (GK4) (Latijnhouwers et al., 2004; Wang et al., 2010; Zhang et al., 2016). Las zoosporas sin pared se enquistan, formando quistes amurallados que germinan y penetran en la planta (Tippett et al., 1976; Ho y Zentmyer, 1977; Otaye, 2005). Las zoosporas móviles uninucleadas, biflageladas, que se liberan desde los zoosporangios son el principal propágulo responsable de las infecciones. Por lo general, P. cinnamomi infecta las raíces alimentadoras finas, pero también puede invadir los tallos leñosos, especialmente a través de heridas o roturas naturales en la capa peridérmica (O’Gara et al., 2015). Durante un estudio de transcriptómica, se detectó durante la infección de Eucalyptus que el gen de P. cinnamomi más expresado en planta fue un efector de «arrugas» (crinklers en Inglés) putativo (CRN1). El análisis filogenético evidenció una alta similitud de este gen CRN1 de P. cinnamomi con el análogo de Phytophthora infestans (Meyer et al., 2016). Se sabe que algunos efectores de CRN se dirigen a los núcleos del hospedante para suprimir respuestas de defensa del hospedante (Stam et al., 2013a; Stam et al., 2013b). Dentro de las 12 h de la inoculación, P. cinnamomi produce un abundante crecimiento de hifas en la superficie de los tallos a partir de quistes unidos al azar, y dentro de las 24 h se observan apresorios de hifas (engrosamientos similares a los apresorios) y zoosporangios (O’Gara et al., 2015). En 2 o 3 días en un hospedante susceptible, se forman zoosporangios en la superficie de la planta. El ciclo asexual puede repetirse muchas veces en rápida sucesión, amplificando rápidamente el potencial de inóculo en el área infectada. El crecimiento dentro del sistema de raíces causa la pudrición de las raíces e interfiere con la absorción y transporte de agua al brote, lo que resulta en el marchitamiento y clorosis del follaje. Las plantas pueden morir rápidamente o sobrevivir, a menudo sin mostrar síntomas de enfermedad, durante muchos años.
La capacidad de P. cinnamomi para crecer de forma saprofita en el suelo y de formar estructuras de resistencia como las clamidosporas, sumado al crecimiento en forma asintomática en plantas infectadas son factores importantes que contribuyen a la capacidad de supervivencia a largo plazo del patógeno. Se cree que las oosporas sexuales, las clamidosporas asexuales y los agregados de hifas intracelulares permiten que el patógeno sobreviva durante largos períodos (muchos años) en condiciones adversas y dificultan enormemente la erradicación completa de la enfermedad (Jung et al., 2013).
P. cinnamomi es heterotálico con los tipos de apareamiento A1 y A2. Sin embargo, incluso en áreas en las que están presentes ambos tipos de apareamiento, se cree que la diversidad genética surge asexualmente más que como resultado de la recombinación sexual. Por lo que P. cinnamomi se reproduce predominantemente asexualmente incluso en presencia de tipos de apareamiento A1 y A2 (Hardham, 2005). P. cinnamomi puede crecer de forma saprofita en el suelo durante largos períodos, aprovechando rápidamente el advenimiento de condiciones favorables para esporular y producir un gran número de zoosporas biflageladas (asexuales). Las zoosporas móviles son atraídas hacia sitios de infección adecuados, donde se adhieren e infectan la planta hospedante. En unos pocos días, las hifas crecen y se ramifican por los tejidos de las plantas susceptibles, formando zoosporangios en la superficie de la planta, amplificando rápidamente el inóculo de la enfermedad.
Las clamidosporas de Phytophthora son estructuras globosas, de 7 a 90 µm de diámetro, separadas del micelio por un tabique basal (Blackwell, 1949; Waterhouse et al., 1983; Erwin y Ribeiro, 1996). No todas las especies de Phytophthora producen clamidosporas y, en algunas especies, solo ciertas cepas las forman (Waterhouse et al., 1983; Stamps et al., 1990; Erwin y Ribeiro, 1996). Se cree que la reproducción asexual y sexual de Phytophthora es provocada por la inanición de micelio (Bartnicki-García y Wang, 1983). Las clamidosporas se consideran estructuras más resistentes que las zoosporas y los zoosporangios, ya que tienen paredes más gruesas y, en las clamidosporas más antiguas, tienen vacuolas con lípidos e inclusiones densas similares a otras esporas resistentes como las oosporas (Hemmes y Wong 1975; Hemmes 1983).
Se sabe que P. cinnamomi puede sobrevivir hasta 6 años en suelo húmedo (Zentmyer y Mircetich, 1966). La humedad es un factor clave en el establecimiento, propagación y longevidad de las enfermedades causadas por P. cinnamomi. La esporulación asexual requiere un ambiente líquido, tanto para la formación de zoosporangios como para la liberación y actividad de zoosporas móviles. El desarrollo de enfermedades aumenta después de fuertes lluvias y en suelos anegados. Las zoosporas biflageladas producidas durante la esporulación asexual no solo son los principales propágulos infecciosos de P. cinnamomi, sino que también poseen una de las características estructurales que caracteriza a los grupos taxonómicos y filogenéticos a los que pertenecen Phytophthora y otros oomicetos, los pelos tripartitos llamados mastigonemas en el flagelo anterior.
.
- Ciclo de vida de Phytophthora cinnamomi. Autor: Hardham, 2005.
.
.
Manejo Integrado
El control de la enfermedad es difícil en situaciones agrícolas, forestales y aún más desafiante en ecosistemas naturales como resultado de la escala del problema y debido al amplio rango de hospedantes del patógeno y su capacidad para sobrevivir en plantas tolerantes o asintomáticas, y la gama limitada de inhibidores químicos efectivos. Las plantas sin síntomas son una fuente importante de propagación hacia áreas previamente no infectadas, lo cual es un problema importante para los viveros forestales.
Como la mayoría de los patógeno asociados al suelo, no existen medios eficaces para erradicar a P. cinnamomi de las áreas infestadas, ya que sobrevive en suelo húmedo o material vegetal muerto como clamidosporas hasta por seis años (Zentmyer y Mircetich, 1966). Las inyecciones de fosfito (PO3) han demostrado ser útiles para combatir P. cinnamomi en Persea americana (palto, avocado o aguacate) (Darvas et al. 1984), especies de Eucalyptus marginata y Banksia (Shearer y Fairman 2007). Algunas industrias, como la del palto, dependen en gran medida de patrones tolerantes para producir suficiente fruto en presencia de P. cinnamomi. Las respuestas de las plantas a P. cinnamomi varían desde muy susceptibles a completamente resistentes (Allardyce et al., 2012; 2013), pero estas respuestas son complejas y difíciles de describir.
Las medidas preventivas a través del saneamiento son fundamentales. La mejor práctica de manejo de campo es prevenir la introducción del organismo en el campo mediante el uso de semillas limpias y material limpio, así como utilizando suelos arenosos bien drenados con un pH bajo. Tanto la producción de zoosporangios como de zoosporas se inhiben a un pH de 3.3. Sin embargo, a un pH superior a 4.0, la producción de zoosporangios aún se inhibe, mientras que la producción de zoosporas no. En plantas cultivadas en contenedores, un pH bajo no es factible porque el crecimiento de la planta es limitado. Sin embargo, para la propagación del corte, mantener el riego por niebla entre 3.5 y 4.0 puede controlar la formación de zoosporangios y así evitará la formación de zoosporas y enfermedades. El control en plantas cultivadas en contenedores se puede lograr mediante el uso de tierra esterilizada, productos químicos (por ej. Fosetyl Al, metalaxyl o etridiazol), material limpio y lechos de grava gruesos e inclinados sobre los cuales colocar las macetas. La severidad de la enfermedad se puede reducir en viveros plantando en camas elevadas. Las camas elevadas evitan que el agua libre entre en contacto con las raíces de las plantas y promueve un drenaje rápido. La fumigación previa a la siembra puede ser eficaz, pero no alcanza las clamidosporas que pueden estar presentes en los suelos en mayor profundidad.
* Evitar situaciones de estrés para los árboles.
* Evitar la compactación del suelo.
* Aplicación foliar o con jeringa en tejidos de conducción de los árboles de activadores de las defensas de las plantas como por ejemplos los fosfitos.
.
.
.
Bibliografía
Allardyce JA, Rookes JE, Cahill DM (2012) Defining plant resistance to Phytophthora cinnamomi: a standardized approach to assessment. J. Phytopathol. 160: 269–276. doi: 10.1111/j.1439-0434.2012.01895.x
Allardyce JA, Rookes JE, Hussain HI, Cahill DM (2013) Transcriptional profiling of Zea mays roots reveals roles for jasmonic acid and terpenoids in resistance against Phytophthora cinnamomi. Funct. Integr. Genomics 13: 217–228. doi: 10.1007/s10142-013-0314-7
Altimira F, Godoy S, Arias-Aravena M, et al. (2022) Genomic and Experimental Analysis of the Biostimulant and Antagonistic Properties of Phytopathogens of Bacillus safensis and Bacillus siamensis. Microorganisms 10(4): 670. doi: 10.3390/microorganisms10040670
Andronis CE, Jacques S, Lipscombe R, Tan KC (2022) Comparative sub-cellular proteome analyses reveals metabolic differentiation and production of effector-like molecules in the dieback phytopathogen Phytophthora cinnamomi. J Proteomics: 104725. doi: 10.1016/j.jprot.2022.104725
Avila-Quezada GD, Rai M (2023) Novel nanotechnological approaches for managing Phytophthora diseases of plants. Trends Plant Sci.: S1360-1385(23)00102-4. doi: 10.1016/j.tplants.2023.03.022
Backer R, Engelbrecht J, van den Berg N (2022) Differing Responses to Phytophthora cinnamomi Infection in Susceptible and Partially Resistant Persea americana (Mill.) Rootstocks: A Case for the Role of Receptor-Like Kinases and Apoplastic Proteases. Front Plant Sci. 13: 928176. doi: 10.3389/fpls.2022.928176
Backer R, Naidoo S, van den Berg N (2023) The expression of the NPR1-dependent defense response pathway genes in Persea americana (Mill.) following infection with Phytophthora cinnamomi. BMC Plant Biol. 23(1): 548. doi: 10.1186/s12870-023-04541-z
Belisle RJ, Hao W, McKee B, et al. (2019) New Oomycota Fungicides With Activity Against Phytophthora cinnamomi and Their Potential Use for Managing Avocado Root Rot in California. Plant Disease 103(8): 2024-2032. doi: 10.1094/PDIS-09-18-1698-RE
Bourret TB, Fajardo SN, Frankel SJ, Rizzo DM (2023) Cataloging Phytophthora Species of Agriculture, Forests, Horticulture, and Restoration Outplantings in California, U.S.A.: A Sequence-Based Meta-Analysis. Plant Dis. 107(1): 67-75. doi: 10.1094/PDIS-01-22-0187-RE
Brasier C, Scanu B, Cooke D, Jung T (2022) Phytophthora: an ancient, historic, biologically and structurally cohesive and evolutionarily successful generic concept in need of preservation. IMA Fungus 13(1): 12. doi: 10.1186/s43008-022-00097-z
Burgess TI, Edwards J, Drenth A, et al. (2021) Current status of Phytophthora in Australia. Persoonia 47: 151-177. doi: 10.3767/persoonia.2021.47.05
Chen Z, Jiao B, Zhou J, et al. (2022) Rapid detection of Phytophthora cinnamomi based on a new target gene Pcinn13739. Front Cell Infect Microbiol. 12: 923700. doi: 10.3389/fcimb.2022.923700
de Andrade Lourenço D, Branco I, Choupina A (2022) A systematic review about biological control of phytopathogenic Phytophthora cinnamomi. Mol Biol Rep. doi: 10.1007/s11033-022-07547-2
de Sampaio e Paiva Camilo-Alves C, da Clara MIE, de Almeida Ribeiro NMC (2013) Decline of Mediterranean oak trees and its association with Phytophthora cinnamomi: a review. Eur J Forest Res 132: 411–432. doi: 10.1007/s10342-013-0688-z
, , (2023) Evaluating the potential of environmentally friendly compounds to deactivate different life stages of Phytophthora species. Plant Pathology 72: 912– 923. doi: 10.1111/ppa.13717
Eggers JE, Balci Y, MacDonald WL (2012) Variation Among Phytophthora cinnamomi Isolates from Oak Forest Soils in the Eastern United States. Plant Disease 96(11): 1608-1614. doi: 10.1094/PDIS-02-12-0140-RE
Ferreira P, Chahed A, Estevinho LM, e al. (2023) Post-Transcriptional Gene Silencing of Glucanase Inhibitor Protein in Phytophthora cinnamomi. Plants (Basel) 12(22): 3821. doi: 10.3390/plants12223821
Gao RF, Wang JY, Liu KW, et al. (2021) Comparative analysis of Phytophthora genomes data. Data Brief. 39: 107663. doi: 10.1016/j.dib.2021.107663
Groves E, Howard K, Hardy G, et al. (2015) Role of salicylic acid in phosphite-induced protection against Oomycetes; a Phytophthora cinnamomi – Lupinus augustifolius model system. Eur J Plant Pathol 141: 559–569. doi: 10.1007/s10658-014-0562-y
Gyeltshen J, Dunstan WA, Grigg AH, et al. (2021) The influence of time, soil moisture and exogenous factors on the survival potential of oospores and chlamydospores of Phytophthora cinnamomi. For. Path. 51: e12637. doi: 10.1111/efp.12637
Hardham AR (2005) Phytophthora cinnamomi. Molecular Plant Pathology 6: 589-604. doi: 10.1111/j.1364-3703.2005.00308.x
Hardham AR, Blackman LM (2018) Phytophthora cinnamomi. Molecular Plant Pathology 19: 260-285. doi: 10.1111/mpp.12568
, , (2013) Phytophthora cinnamomi in Australia. In Phytophthora: A Global Perspective (Lamour, K., ed.). pp. 124–134. Wallingford, UK: CAB International. Link
Hunter S, Williams N, McDougal R, et al. (2018) Evidence for rapid adaptive evolution of tolerance to chemical treatments in Phytophthora species and its practical implications. PLoS One 13(12): e0208961. doi: 10.1371/journal.pone.0208961
Hunter S, McDougal RL, Williams N, Scott P (2022) Evidence of phosphite tolerance in Phytophthora cinnamomi from New Zealand avocado orchards. Plant Dis. doi: 10.1094/PDIS-05-22-1269-RE
Jolliffe JB, Dann EK, Van Der Rijst M, et al. (2023) Effect of sampling time, quantification method and tree sample pooling on Phytophthora cinnamomi root quantities in South African avocado orchards. Plant Dis. doi: 10.1094/PDIS-07-23-1457-RE
Jung T, Colquhoun IJ, Hardy GESJ (2013) New insights into the survival strategy of the invasive soilborne pathogen Phytophthora cinnamomi in different natural ecosystems in Western Australia. For. Path., 43: 266-288. doi: 10.1111/efp.12025
Kato F, Ando Y, Tanaka A, et al. (2022) Synthesis of aglycones, structure-activity relationships, and mode of action of lycosides as inhibitors of the asexual reproduction of Phytophthora. Biosci Biotechnol Biochem.: zbac179. doi: 10.1093/bbb/zbac179
, ,
Kronmiller BA, Feau N, Shen D, et al. (2023) Comparative Genomic Analysis of 31 Phytophthora Genomes Reveals Genome Plasticity and Horizontal Gene Transfer. Mol Plant Microbe Interact. 36(1): 26-46. doi: 10.1094/MPMI-06-22-0133-R
Latijnhouwers M, Ligterink W, Vleeshouwers VG, et al. (2004) A Gα subunit controls zoospore motility and virulence in the potato late blight pathogen Phytophthora infestans. Molecular Microbiology 51: 925-936. doi: 10.1046/j.1365-2958.2003.03893.x
Liew ECY, Phelan M, McDougall KL (2023) The efficacy of a range of hygiene measures for boot cleaning to protect natural vegetation from Phytophthora cinnamomi. Sci Rep. 13(1): 5825. doi: 10.1038/s41598-023-32681-7
Lin X, Torres Ascurra YC, Fillianti H, et al. (2023) Recognition of Pep-13/25 MAMPs of Phytophthora localizes to an RLK locus in Solanum microdontum. Front Plant Sci. 13: 1037030. doi: 10.3389/fpls.2022.1037030
, , , et al. (2022) Resistance, tolerance and competence for a root pathogen in six woody species. Plant Pathology 71: 1700– 1711. doi: 10.1111/ppa.13608
McCarren KL, McComb JA, Shearer BL, et al. (2005) The role of chlamydospores of Phytophthora cinnamomi; a review. Australasian Plant Pathology 34: 333–338. doi: 10.1071/AP05038
, , , et al. (2023) Temporal colonization of macadamia tree roots by Phytophthora cinnamomi based on a newly developed quantitative real-time PCR assay. Plant Pathology 73: 366–377. doi: 10.1111/ppa.13819
, , , et al (2023) Greater rate of nitrogen fertilizer application increases root rot caused by Phytophthora cinnamomi and P. plurivora in container-grown rhododendron. Plant Pathology 72: 1604–1614. doi: 10.1111/ppa.13776
Meyer FE, Shuey LS, Naidoo S, et al. (2016) Dual RNA-Sequencing of Eucalyptus nitens during Phytophthora cinnamomi Challenge Reveals Pathogen and Host Factors Influencing Compatibility. Front. Plant Sci. 7: 191. doi: 10.3389/fpls.2016.00191
Neupane K, Ghimire B, Baysal-Gurel F (2022) Efficacy and Timing of Application of Fungicides, Biofungicides, Host-Plant Defense Inducers, and Fertilizer to Control Phytophthora Root Rot of Flowering Dogwoods in Simulated Flooding Conditions in Container Production. Plant Disease. doi: 10.1094/PDIS-02-22-0437-RE
O’Gara E, Howard K, McComb J, et al. (2015) Penetration of suberized periderm of a woody host by Phytophthora cinnamomi. Plant Pathol 64: 207-215. doi: 10.1111/ppa.12244
(2005) Repeated Emergence, Motility, and Autonomous Dispersal by Sporangial and Cyst Derived Zoospores of Phytophthora spp. Oklahoma, USA: Oklahoma State University, PhD thesis. Link
Pilotti M, Di Lernia G, Lumia V, Riccioni L (2014) Phytophthora cinnamon causing stem canker and root rot of nursery-grown Platanus. Phytopathologia Mediterranea 53: 75-82. doi: 10.14601/Phytopathol_Mediterr-11836
Reitmann A, Berger DK, van den Berg N (2017) Putative pathogenicity genes of Phytophthora cinnamomi identified via RNA-Seq analysis of pre-infection structures. Eur J Plant Pathol 147: 211–228. doi: 10.1007/s10658-016-0993-8
Stam R, Howden AJM, Delgado-Cerezo M, et al. (2013a). Characterization of cell death inducing Phytophthora capsici CRN effectors suggests diverse activities in the host nucleus. Front. Plant Sci. 4: 387. doi: 10.3389/fpls.2013.00387
Stam R, Jupe J, Howden AJ, et al. (2013b) Identification and characterisation CRN effectors in Phytophthora capsici shows modularity and functional diversity. PLoS ONE 8: e59517. doi: 10.1371/journal.pone.0059517
Situ J, Xi P, Lin L, et al. (2022) Signal and regulatory mechanisms involved in spore development of Phytophthora and Peronophythora. Front Microbiol. 13: 984672. doi: 10.3389/fmicb.2022.984672
van den Berg N, Swart V, Backer R, et al. (2021) Advances in Understanding Defense Mechanisms in Persea americana Against Phytophthora cinnamomi. Front. Plant Sci. 12: 636339. doi: 10.3389/fpls.2021.636339
Varghese B, Valsalan R, Mathew D (2022) Novel MicroRNAs and their Functional Targets from Phytophthora infestans and Phytophthora cinnamomi. Curr Genomics. 23(1): 41-49. doi: 10.2174/1389202923666211223122305
, , , (2010) GPR11, a putative seven-transmembrane G protein-coupled receptor, controls zoospore development and virulence of Phytophthora sojae. Eukaryot. Cell, 9: 242–250. doi: 10.1128/EC.00265-09
Williams N, Hardy GESJ, O’Brien PA (2009) Analysis of the distribution of Phytophthora cinnamomi in soil at a disease site in Western Australia using nested PCR. Forest Pathology 39: 95-109. doi: 10.1111/j.1439-0329.2008.00567.x
Zhang X, Zhai C, Hua C, et al. (2016) A Gα-binding protein is required for chemotaxis. Molecular Plant Pathology 17: 272-285. doi: 10.1111/mpp.12279
Zhang Y, Kong WL, Wu XQ, Li PS (2022) Inhibitory effects of phenazine compounds and VOCs produced by Pseudomonas aurantiaca ST-TJ4 against Phytophthora cinnamomi. Phytopathology. doi: 10.1094/PHYTO-10-21-0442-R
(1980) Phytophthora cinnamomi and the Diseases it Causes. St Paul, MN: The American Phytopathological Society.
Zentmyer GA (1988) Origin and distribution of four species of Phytophthora. Transactions of the British Mycological Society 91: 367-378. doi: 10.1016/S0007-1536(88)80111-6