.
Condición fitosanitaria: Plaga Cuarentenaria Ausente
Grupo de cultivos: Hortícolas
Especie hospedante: Papa (Solanum tuberosum L.)
Rango de hospedantes: C. michiganensis infecta solanáceas como papa (subsp. sepedonicus), tomate (subsp. michiganensis), pimiento (subsp. capsici) y berenjena (subsp. michiganensis / sepedonicus). Las cepas muestran una gran variabilidad en la virulencia y generalmente se describen como hipervirulentas, hipovirulentas o no virulentas (Sen et al., 2015).
Etiología: Bacteria. Gram positiva (*)
Agente causal: Clavibacter michiganensis subsp. sepedonicus (Cmss) corrig. (Spieckermann and Kotthoff 1914) Davis et al. 1984
Taxonomía: Bacteria > Terrabacteria group > Actinobacteria > Micrococcales > Microbacteriaceae > Clavibacter
(*) puede considerarse un patógeno vegetal hemibiotrófico (principalmente biotrófico y moderadamente necrotrófico) (Gartemann et al., 2008).
.
Cmss es una bacteria Gram positiva, corineforme, aeróbica, no formadora de esporas de la familia Microbacteriaceae de Actinobacteria. C. michiganensis es la única especie actualmente reconocida dentro del género; y sus seis subespecies (subspp. insidiosus, michiganensis, nebraskensis, phaseoli, sepedonicus y tesselarius) son patógenos de plantas.
.
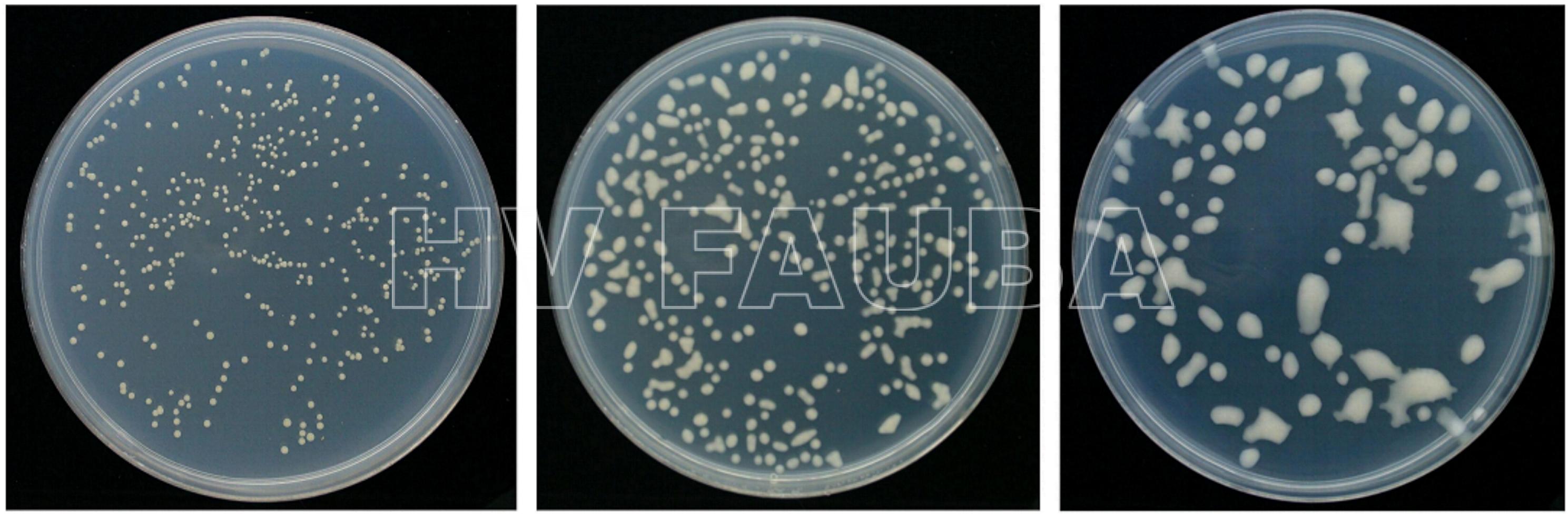
- Morfología de colonias de Clavibacter michiganensis subsp. sepedonicus. Autor: Przewodowski et al., 2017.
.
.
Antecedentes
.
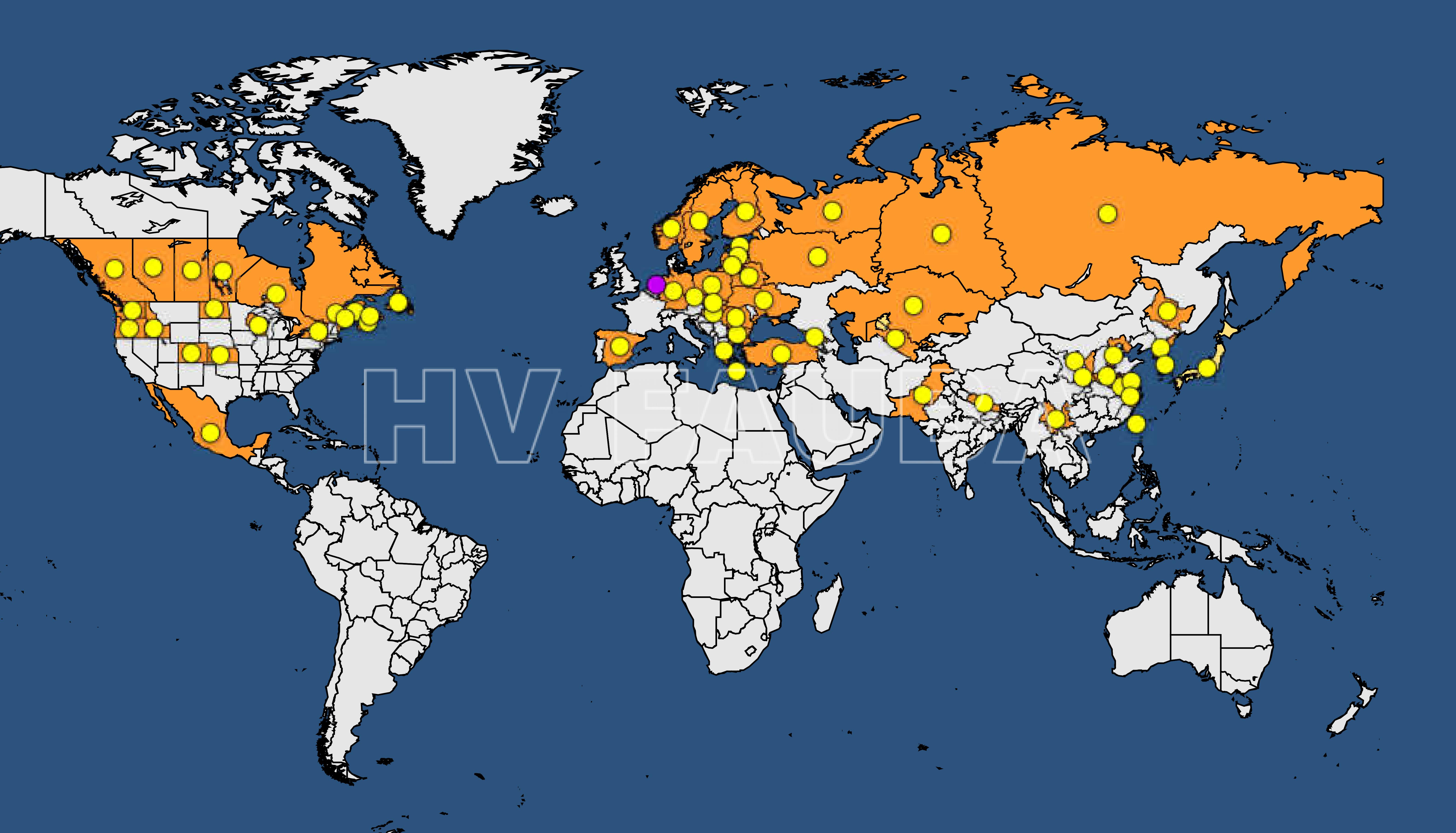
Distribución geográfica
.
- Fuente: https://gd.eppo.int/taxon/CORBSE/distribution
.
Importancia económica
.
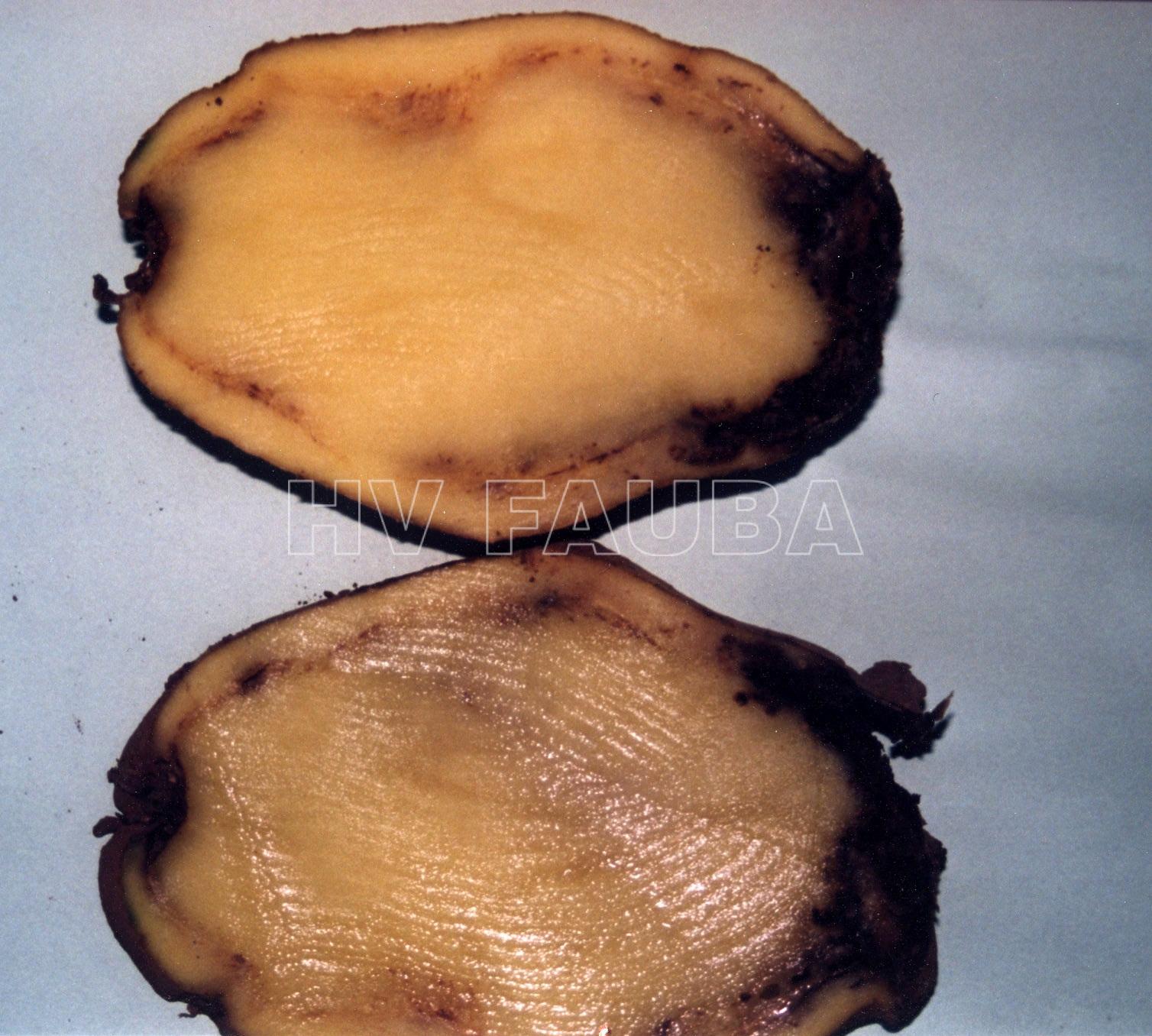
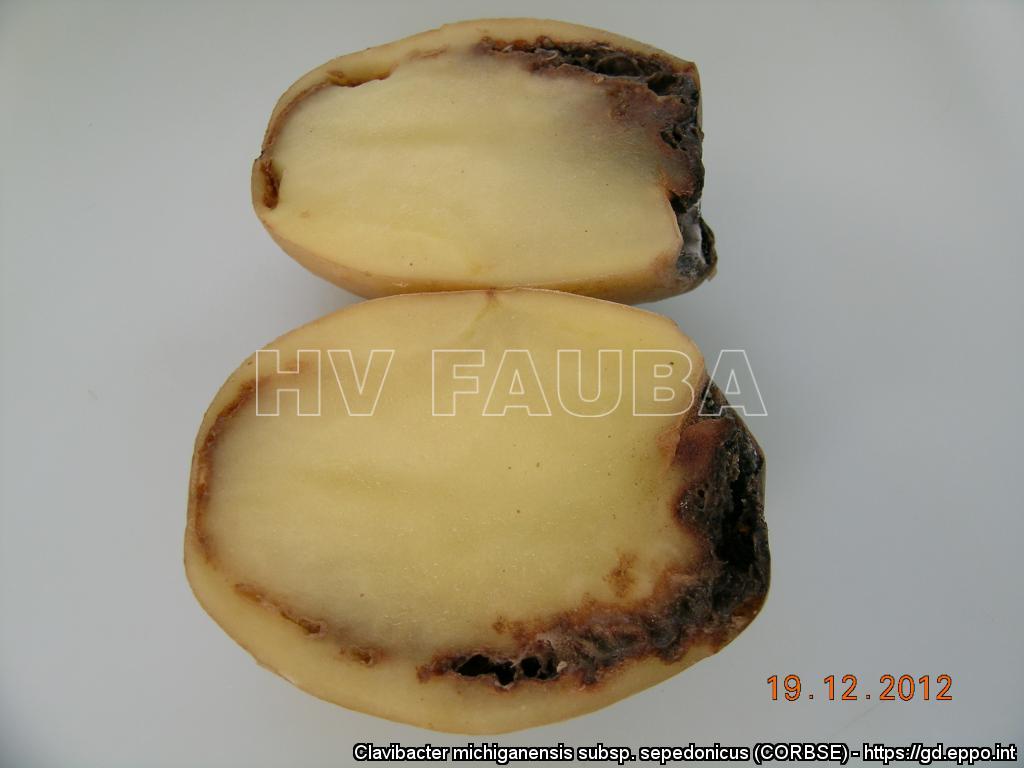
Sintomatología
.
- Fuente: www.phytoma.com
- Autor: https://gd.eppo.int/taxon/CORBSE/photos
.
.
Bibliografía
Arahal DR, et al. (2004) In silico evaluation of molecular probes for detection and identification of Ralstonia solanacearum and Clavibacter michiganensis subsp. sepedonicus. System. Appl. Microbiol. 27: 581–591. doi: 10.1078/0723202041748208
Bentley SD, Corton C, Brown SE, et al. (2008). Genome of the actinomycete plant pathogen Clavibacter michiganensis subsp. sepedonicus suggests recent niche adaptation. Journal of bacteriology 190(6): 2150–2160. doi: 10.1128/JB.01598-07
Cho MS, et al. (2015) Validation and application of a real-time PCR protocol for the specific detection and quantification of Clavibacter michiganensis subsp. sepedonicus in Potato. Plant. Pathol. J. 31: 123–131. doi: 10.5423/PPJ.OA.02.2015.0019
Dobhal S, et al. (2019) Development of a loop-mediated isothermal amplification assay for specific detection of all known subspecies of Clavibacter michiganensis. J. Appl. Microbiol. 126: 388–401. doi: 10.1111/jam.14128
EFSA PLH Panel (EFSA Panel on Plant Health), (2019) Scientific opinion on the pest categorisation of Clavibacter sepedonicus. EFSA Journal 17(4): 5670. doi: 10.2903/j.efsa.2019.5670
Franc GD (1999) Persistence and Latency of Clavibacter michiganensis subsp. sepedonicus in Field-Grown Seed Potatoes. Plant Disease 83(3): 247-250. doi: 10.1094/PDIS.1999.83.3.247
Gudmestad NC, et al. (2009) A real-time PCR assay for the detection of Clavibacter michiganensis subsp. sepedonicus based on the cellulase A gene sequence. Plant. Disease 93: 649–659. doi: 10.1094/PDIS-93-6-0649
Ignatov AN, et al. (2018) First Report of Clavibacter michiganensis subsp. sepedonicus Infecting Sugar Beet in Russia. Plant Disease 102: 2634. doi: 10.1094/PDIS-04-18-0693-PDN
Li X, De Boer SH (1995) Selection of Polymerase Chain Reaction Primers from an RNA Intergenic Spacer Region for Specific Detection of Clavibacter michiganensis subsp. sepedonicus. Phytopathology 85: 837-842. doi: 10.1094/Phyto-85-837
Li X, Tambong J, Yuan KX, et al. (2018) Re-classification of Clavibacter michiganensis subspecies on the basis of whole-genome and multi-locus sequence analyses. Int J Syst Evol Microbiol. 68(1): 234-240. doi:
Mills D, et al. (1997) Specific Detection of Clavibacter michiganensis subsp. sepedonicus by amplification of three unique DNA sequences isolated by subtraction hybridization. Phytopathology 87: 853–861. doi: 10.1094/PHYTO.1997.87.8.853
OEPP⁄EPPO (2006) EPPO Standards PM 7⁄59 (1) Diagnostic protocol – Clavibacter michiganensis subsp. sepedonicus. Bulletin OEPP⁄EPPO Bulletin 36: 99–109.
Pastrik K-H (2000) Detection of Clavibacter michiganensis subsp. sepedonicus in potato tubers by multiplex PCR with coamplification of host DNA. Eur. J. Plant. Pathol. 106: 155–165. doi: 10.1023/A:100873601
Przewodowski W, Przewodowska A (2017) Development of a sensitive and specific polyclonal antibody for serological detection of Clavibacter michiganensis subsp. sepedonicus. PLoS One 12: 1–21. doi: 10.1371/journal.pone.0169785
Sadunishvili T, Węgierek-Maciejewska A, Arseniuk E, et al. (2020) Molecular, morphological and pathogenic characterization of Clavibacter michiganensis subsp. sepedonicus strains of different geographic origins in Georgia. Eur J Plant Pathol 158: 195–209. doi: 10.1007/s10658-020-02066-x
Sagcan H, Turgut Kara N (2019) Detection of Potato ring rot Pathogen Clavibacter michiganensis subsp. sepedonicus by Loop-mediated isothermal amplification (LAMP) assay. Sci Rep. 9(1): 20393. doi: 10.1038/s41598-019-56680-9
Schaad NW, Berthier-Schaad Y, Sechler A, Knorr D (1999) Detection of Clavibacter michiganensis subsp. sepedonicus in Potato Tubers by BIO-PCR and an Automated Real-Time Fluorescence Detection System. Plant Disease 83(12): 1095-1100. doi: 10.1094/PDIS.1999.83.12.1095
Stevens LH, et al. (2017) Chemical eradication of the ring rot bacterium Clavibacter michiganensis subsp. sepedonicus on potato storage crates. Potato Res. 60: 145–158. doi: 10.1007/s11540-017-9342-3
Węgierek-Maciejewska A, Masny A, Wołkowicz T, et al. (2019) PCR MP method for differentiation of Clavibacter michiganensis subsp. sepedonicus isolates. Am. J. Potato Res. 96: 588–604. doi: 10.1007/s12230-019-09752-5