q.
Condición fitosanitaria: Presente
Grupo de cultivos: Hortícolas
Especie hospedante: Tomate (Solanum lycopersicum)
Rango de hospedantes: C. michiganensis infecta solanáceas como tomate (subsp. michiganensis), papa (subsp. sepedonicus), pimiento (subsp. capsici) y berenjena (subsp. michiganensis / sepedonicus). Las cepas muestran una gran variabilidad en la virulencia y generalmente se describen como hipervirulentas, hipovirulentas o no virulentas (Sen et al., 2015).
Epidemiología: policíclica, subaguda
Etiología: Bacteria. Gram positiva (*)
Agente causal: Clavibacter michiganensis subsp. michiganensis (Cmsm) corrig. (Smith 1910) Davis et al. 1984
Taxonomía: Bacteria > Terrabacteria group > Actinobacteria > Micrococcales > Microbacteriaceae > Clavibacter
.
(*) puede considerarse un patógeno vegetal hemibiotrófico (principalmente biotrófico y moderadamente necrotrófico) (Gartemann et al., 2008).
.
Cmsm es una bacteria Gram positiva, corineforme, aeróbica, no formadora de esporas de la familia Microbacteriaceae de Actinobacteria. C. michiganensis es la única especie actualmente reconocida dentro del género; y sus seis subespecies (subspp. insidiosus, michiganensis, nebraskensis, phaseoli, sepedonicus y tesselarius) son patógenos de plantas. Hasta la fecha, se han reportado seis subespecies diferentes que causan enfermedades en las plantas en especies de C. michiganensis, incluyendo C. michiganensis subsp. michiganensis, que causa la enfermedad del cancro bacteriano del tomate (Solanum lycopersicum) (Davis et al., 1984; Strider, 1969); C. michiganensis subsp. sepedonicus, causante de la pudrición anular en papa (Solanum tuberosum) (Eichenlaub & Gartemann, 2011); C. michiganensis subsp. nebraskensis, que causa la enfermedad del marchitamiento y el tizón en el maíz (Zea mays) (Vidaver & Mandel, 1974); C. michiganensis subsp. insidiosus, que causa marchitez y atrofia en la alfalfa (Medicago sativa) (Mcculloch, 1925); C. michiganensis subsp. tessellarius, que causa pecas en las hojas y manchas en las hojas del trigo (Triticum aestivum) (Eichenlaub & Gartemann, 2011); y C. michiganensis subsp. phaseoli, causando amarillamiento de hojas en frijol (Phaseolus vulgaris L.) (González & Trapiello, 2014; Trapiello & González, 2012). Recientemente, dos subespecies adicionales asociadas a semillas y no patógenas, C. michiganensis subsp. californiensis y C. michiganensis subsp. chilensis, han sido reportadas (Yasuhara-Bell & Alvarez, 2015).
.
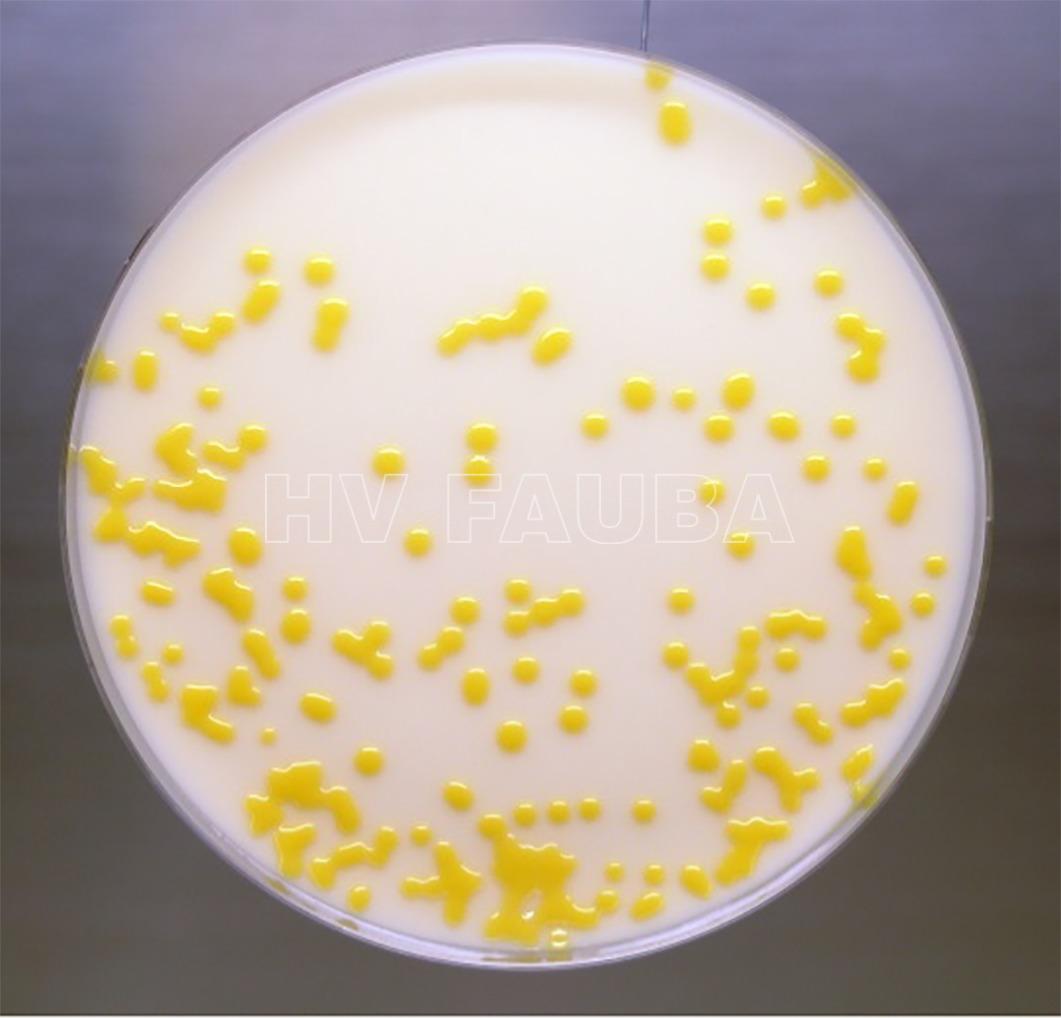
- Colonias de C. michiganensis subsp. michiganensis en medio YDC a los 3 días del estriado. Fuente: OEPP EPPO Standards
.
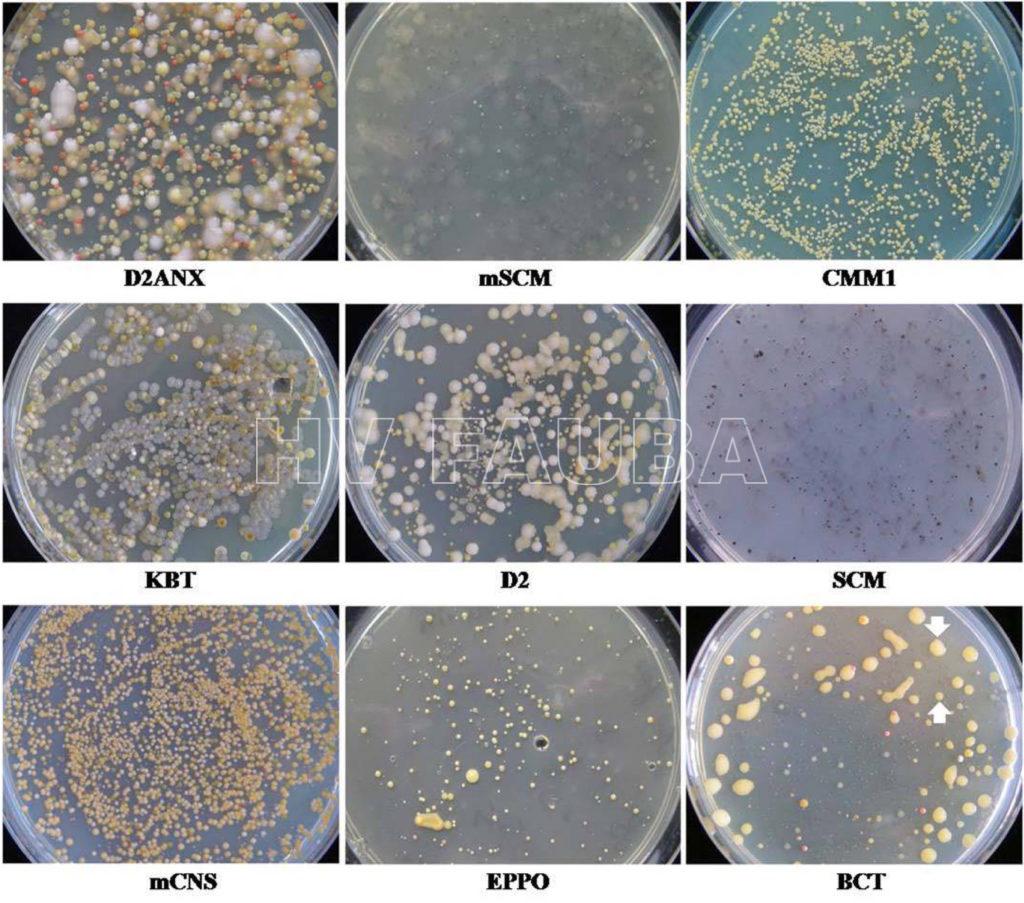
- 01 Crecimiento de Clavibacter michiganensis subsp. michiganensis en el medio de cultivo BCT (bacterial canker of tomato): las colonias son brillantes, convexas, viscosas y circulares, y el color varía desde el blanco cremoso al principio hasta el amarillo posterior. Fuente: Ftayed et al., 2011
- 02 Detección de Clavibacter michiganensis subsp. michiganensis (Cmm) en muestras de plantas asintomáticas en diferentes medios de cultivo. Cuando las muestras de plantas solo se infectaron ligeramente con Cmm y altamente contaminadas con bacterias saprófitas, se detectó Cmm solo en el medio BCT (bacterial canker of tomato). En BCT, las colonias de Cmm son fácilmente reconocibles (de color cremoso a amarillo, convexo, brillante y con el tiempo aumentado de tamaño), mientras que las colonias de saprófitos se observan en este ejemplo deprimidas (pequeñas, débiles y principalmente de color blanco). Fuente: Ftayed et al., 2011
.
.
Antecedentes
Es considerada la enfermedad bacteriana más grave del tomate, responsable de pérdidas económicas muy importantes en todo el mundo. Fue detectada por primera vez en Michigan, EE.UU., en 1910. En años recientes ha resurgido abruptamente en producciones bajo cubierta en Israel, Japón, Islas Canarias, Serbia, Francia y Bélgica. La importancia de la misma se debe a la pérdida total de las plantas más afectadas y a la dificultad de manejo.
.
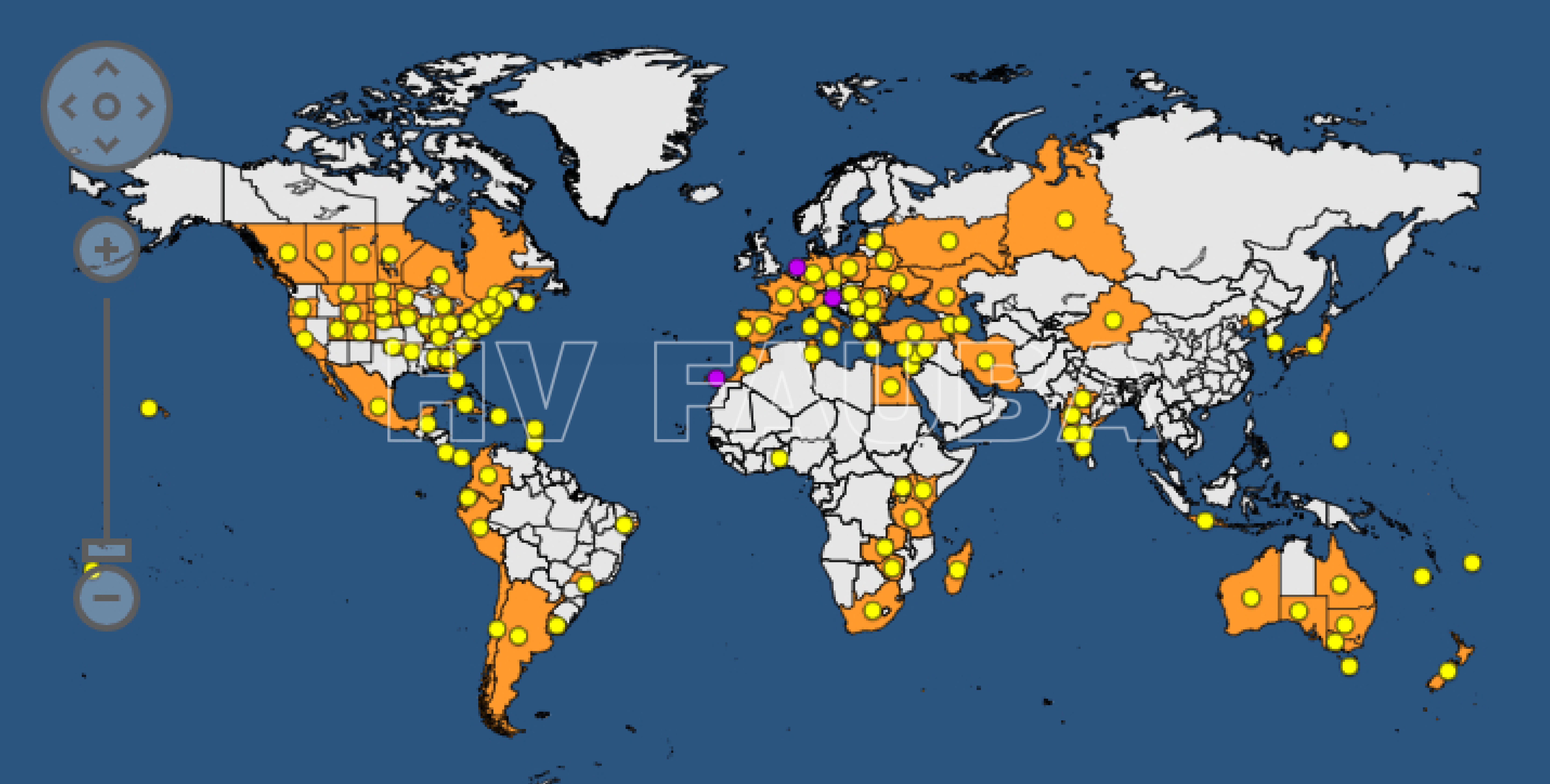
Distribución geográfica
Está presente en las principales zonas productoras de tomate del mundo. En la Argentina tiene una gran prevalencia en los invernaderos del cinturón verde de Buenos Aires-La Plata. También se la ha detectado en Mendoza, Jujuy, Salta, Santa Fe, Corrientes, Formosa, Misiones, La Rioja, San Juan y Río Negro.
.
.
- Distribución mundial del Cancro bacteriano, causado por Clavibacter michiganensis subsp. michiganensis. Fuente: EPPO database (https://gd.eppo.int/taxon/CORBMI/distribution)
.
Importancia económica
Puede ocasionar pérdidas de rendimiento de entre el 20 y el 80 %. En España se han informado casos de pérdida de un 90 % de las plantas. En ensayos con tomate a campo para industria se determinó que por cada 10 % de aumento en la incidencia de la enfermedad se pierde un 5-7 % de rendimiento. En la Argentina, en la zona hortícola que rodea a La Plata tiene una alta prevalencia, con una incidencia de plantas enfermas de entre el 2 y el 100 %, hacia el fin del cultivo.
.
- Cultivo de tomate con ataque severo de cancro bacteriano en invernáculo, Villa María, Córdoba. Autora: Dra. Verónica Felipe
.
Hospedantes
El único hospedante cultivado importante es el tomate. En USA, Brasil, Corea y Países Bajos se han encontrado aislamientos que pueden infectar al pimiento, causando síntomas leves (Latin et al., 1995; Lee et al., 1999; Lewis Ivey y Miller, 2000; Yim et al., 2012; Oh et al., 2016). Puede vivir como epífita en algunas malezas, aunque se desconoce la importancia epidemiológica de esas poblaciones.
.
- Síntomas típicos del cancro bacteriano: A y B, decoloración del tallo, C, marchitamiento unilateral, D y E, plantas de tomate muertas debido al cancro bacteriano, F y G, cancro del tallo. Autor: Sen et al., 2015.
.
.
Sintomatología
El patógeno coloniza sistémicamente el xilema del tomate, lo que conduce a la marchitez unilateral de los folíolos, necrosis marginal de las hojas, cancros en el tallo y el pecíolo y eventualmente la muerte de las plantas.
El cancro bacteriano del tomate es una enfermedad vascular. Por lo general, primero algunos folíolos de un lado de una hoja se ven fláccidos, progresando a una marchitez que alcanza a toda la hoja, y luego a otras hojas. Según el momento de ataque y la cantidad de haces vasculares afectados, la planta entera puede morir. Las hojas muertas quedan retenidas en la planta. En cortes transversales se observa decoloración de los tallos y pecíolos. Si la bacteria entra por hidatodos, se observan necrosis marginales, dándole a las hojas apariencia de haber sido quemadas. En los frutos pueden aparecer lesiones necróticas pequeñas, rodeadas por un halo blanquecino (ojo de pájaro). Con humedad elevada pueden aparecer cancros en los tallos y pecíolos.
.
- Fuente: www.gd.eppo.int
- Fuente: www.gd.eppo.int
- Autor: Paul Bachi, University of Kentucky, Research and educational center, Bugwood.org
- Fuente: www.gd.eppo.int
- Autor: Goldlocki
.
.
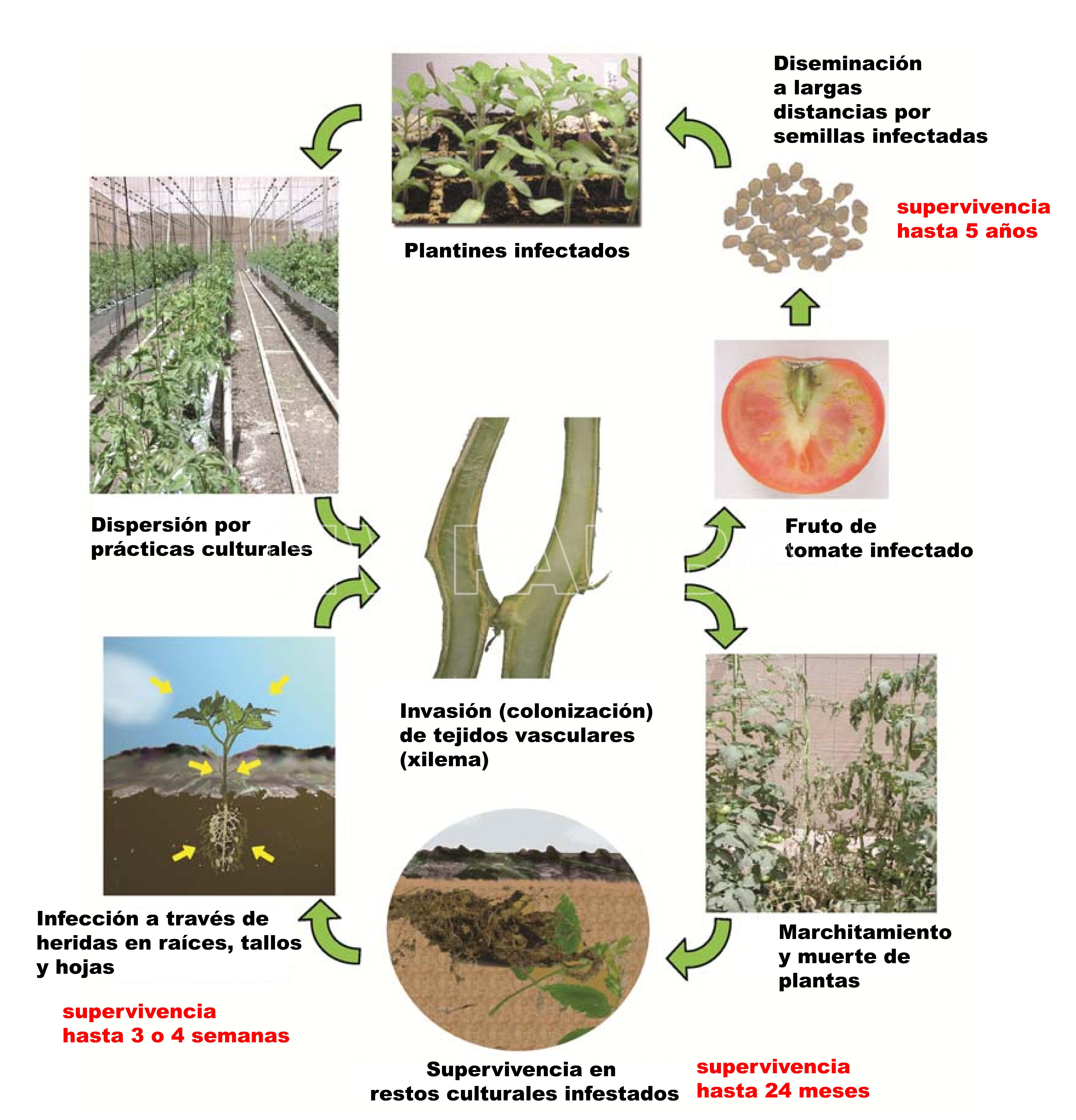
Ciclo de la enfermedad
El patógeno sobrevive en semillas (mínimo 5 años) y rastrojos de plantas enfermas (hasta 24 meses), los que constituyen la fuente de inóculo primario. En tomate de campo en zonas frías el patógeno persiste más de dos años en tallos dejados en superficie, mientras que en zonas templadas no sobrepasa los siete meses. En tomate de invernadero en Buenos Aires la supervivencia depende de la época de cultivo: en cultivos de primavera que finalizan en verano es de menos de 2,5 meses, mientras que en cultivos de verano que finalizan en otoño/invierno, es de 4 a 7 meses, dependiendo si los rastrojos fueron enterrados o se dejaron en la superficie del suelo. Dentro del cultivo, los ciclos secundarios se producen por dispersión de la bacteria durante las labores (transplante, desbrote, deshoje, etc.). En cultivos en el campo la dispersión secundaria también ocurre por lluvia y riego por aspersión.
La infección generalmente ocurre por heridas o estomas, seguida de la invasión de los vasos del xilema. Estos son destruidos por la acción de enzimas, principalmente pectinasas y celulasas. La presencia de bacterias y de sus polisacáridos extracelulares contribuye al taponamiento de los vasos xilemáticos. La infección sistémica culmina en marchitez y cancro.
.
- Ciclo de infección de tomate por Clavibacter michiganensis subsp. michiganensis. Autor: Sen et al., 2015.
.
El hábitat principal de Cmsm dentro de la planta es el fluido xilemático poco ácido y pobre en nutrientes. El patógeno generalmente se encuentra en títulos altos en los tejidos vegetales (109 UFC/g de tejido).
En ocasiones, dependiendo de las condiciones ambientales y la edad de la planta al momento de la infección, las plantas afectadas permanecen asintomáticas (infecciones latentes) o con síntomas leves. Las plantas con infecciones latentes pueden ser la fuente de semillas contaminadas, que es la principal causa de brotes de la enfermedad.
.
- Cultivo de tomate con ataque severo de cancro bacteriano en invernáculo, Villa María, Córdoba. Autora: Dra. Verónica Felipe
- Autor: Ed Sikora
.
Condiciones predisponentes
La enfermedad se ve favorecida por alta humedad del suelo (lluvias, riego), desbalances nutricionales, especialmente exceso de nitrógeno.
.
- Ciclo del cancro bacteriano del tomate, causado por Clavibacter michiganensis subsp. michiganensis, Autor: de León et al., 2011.
.
.
Manejo integrado de la enfermedad
Todas las medidas aplicadas son preventivas. Por tratarse de una enfermedad vascular, una vez que aparecen los síntomas no hay posibilidades de control. No hay híbridos ni variedades de tomate con buenos niveles de resistencia.
Con el fin de reducir el inóculo inicial, se recomienda utilizar semilla libre del patógeno y rotar de cultivo. También se pueden desinfectar las semillas con ácidos o por inmersión en agua a 52- 56ºC durante 20-30 minutos. La duración de la rotación dependerá del clima, la época y el sistema de cultivo.
Para disminuir la tasa epidemiológica, es conveniente destruir las plantas enfermas tan pronto son detectadas en el cultivo y desinfectar las herramientas de poda (cuchillas o tijeras). Mantener una nutrición equilibrada de las plantas y evitar el exceso de agua.
.
- 01 Síntomas de marchitamiento por Clavibacter michiganesis subsp. michiganensis en tomate. Autora: Dra Ana María Romero.
- 02 Síntomas de marchitamiento por Clavibacter michiganesis subsp. michiganensis en corte longitudinal de tallo de tomate. Autora: Dra Ana María Romero.
- 03 Síntomas de marchitamiento por Clavibacter michiganesis subsp. michiganensis en tomate. Autora: Dra. Ana María Romero.
- 01 Zooglea de Clavibacter michiganesis subsp. michiganensis en tomate. Autora: Dra. Ana María Romero.
- 05 Síntomas del Cancro bacteriano en Invernáculo. Autora: Dra. Ana María Romero
- Autor: Goldlocki
- Autor: Ed Sikora
- Autor: Ed Sikora
.
- Cultivo de tomate con ataque severo de cancro bacteriano en invernáculo, Villa María, Córdoba. Autor: Dra. Verónica Felipe
- Cultivo de tomate con ataque severo de cancro bacteriano en invernáculo, Villa María, Córdoba. Autor: Dra. Verónica Felipe
- Cultivo de tomate con ataque severo de cancro bacteriano en invernáculo, Villa María, Córdoba. Autor: Dra. Verónica Felipe
.
- 1112/5000 Colonización de frutos de tomate por C. michiganensis subsp. michiganensis con diferentes métodos de inoculación. (A a D) Inoculación externa. (A) Lesiones en el exocarpio del tomate; (B y C) fuerte colonización bacteriana de haces vasculares de pericarpio; (D) imagen confocal del haz vascular mencionado en B y C. (E a H) Inoculación sistémica. (E) Fruto con haces vasculares de pedicelo descoloridos; (F y G) colonización bacteriana intensa de haces vasculares de pericarpio; (H) haces vasculares colonizados por C. michiganensis subsp. michiganensis; (I a L) Inoculación con agua. (I) Control negativo sin lesiones en el fruto o decoloración de haces vasculares del pedicelo; (J a L) Control negativo de los haces vasculares del pericarpio. Las flechas rojas indican una fuerte colonización vascular por C. michiganensis subsp. michiganensis. Las flechas blancas indican haces vasculares no colonizados. Barras de escala: 1 mm en los paneles C, G y K; 200 μm en los paneles D y H; 100 μm en panel L. Autor: Tancos et al., 2013.
.
.
.
Bibliografía
(2016), PM 7/42 (3) Clavibacter michiganensis subsp. michiganensis. EPPO Bull, 46: 202-225. doi: 10.1111/epp.12302
Alvarez AM, Kaneshiro WS, Vine BG (2004) Diversity of Clavibacter michiganensis subsp. michiganensis populations in tomato seed: What is the significance. Acta Horticulturae (ISHS) 695: 205-214. doi: 10.17660/ActaHortic.2005.695.23
Basım H, Basım E (2018) Phenotypic and genotypic characterization of Clavibacter michiganensis subsp. michiganensis causing tomato bacterial canker and wilt disease in Turkey. European Journal of Plant Pathology 151(2): 355–369. doi: 10.1007/s10658-017-1378-3
Bermpohl A, Dreier J, Bahro R, Eichenlaub R (1996) Exopolysaccharides in the pathogenic interaction of Clavibacter michiganensis subsp. michiganensis with tomato plants. Microbiological Research 151: 391-399. doi: 10.1016/S0944-5013(96)80009-7
Chalupowicz L, Barash I, Reuven M, Dror O, Sharabani G, Gartemann K-H, Eichenlaub R, Sessa G, Manulis-Sasson S (2017) Differential contribution of Clavibacter michiganensis ssp. michiganensis virulence factors to systemic and local infection in tomato. Molecular Plant Pathology 18: 336–346. doi: 10.1111/mpp.12400
Chitarra LG, Breeuwer P, Van Den Bulk RW, Abee T (2000) Rapid fluorescence assessment of intracellular pH as a viability indicator of Clavibacter michiganensis subsp. michiganensis. J Appl Microbiol. 88(5): 809-916. doi: 10.1046/j.1365-2672.2000.01014.x
Cordon G, Andrade C, Barbara L, Romero A (2021) Early detection of tomato bacterial canker by reflectance indices. Information Processing in Agriculture. doi: 10.1016/j.inpa.2021.06.004
Coskun TA, Horuz S (2023) Phosphites for the management of tomato bacterial canker and stem rot. J Plant Dis Prot 130: 609–617. doi: 10.1007/s41348-023-00725-9
de León L, Siverio F, López MM, Rodríguez A (2011) Clavibacter michiganesis subsp. michiganensis, a Seedborne Tomato Pathogen: Healthy Seeds Are Still the Goal. Plant Disease 95(11): 1328-1338. doi: 10.1094/PDIS-02-11-0091
Duc NH, Posta K (2018) Mycorrhiza-induced alleviation of plant disease caused by Clavibacter michiganensis subsp. michiganensis and role of ethylene in mycorrhiza-induced resistance in tomato. Acta Biologica Hungarica 69(2). doi: 10.1556/018.69.2018.2.6
Eichenlaub R, Gartemann KH, Burger A (2007) Clavibacter michiganensis, a group of gram-positive phytopathogenic bacteria. In: Gnanamanickam S.S. (eds) Plant-Associated Bacteria. Springer, Dordrecht. doi: 10.1007/978-1-4020-4538-7_12
Eichenlaub R, Gartemann KH (2011) The Clavibacter michiganensis Subspecies: Molecular Investigation of Gram-Positive Bacterial Plant Pathogens. Annual Review of Phytopathology 49: 445-464. doi: 10.1146/annurev-phyto-072910-095258
Fatmi M, Bolkan H, Schaad NW (2017) Detection of Clavibacter michiganensis subsp. michiganensis in Tomato Seeds. In: Detection of Plant-Pathogenic Bacteria in Seed and Other Planting Material, Second Edition. doi: 10.1094/9780890545416.017
Ftayeh RM, von Tiedemann A, Rudolph KWE (2011) A New Selective Medium for Isolation of Clavibacter michiganensis subsp. michiganensis from Tomato Plants and Seed. Phytopathology 101(11): 1355-1364. doi: 10.1094/PHYTO-02-11-0045
Gartemann KH, Kirchner O, Engemann J, et al. (2003) Clavibacter michiganensis subsp. michiganensis: first steps in the understanding of virulence of a Gram-positive phytopathogenic bacterium. Journal of Biotechnology 106(2-3): 179-191. doi: 10.1016/j.jbiotec.2003.07.011
Gartemann KH, Abt B, Bekel T, et al. (2008) The genome sequence of the tomato-pathogenic actinomycete Clavibacter michiganensis subsp. michiganensis NCPPB382 reveals a large island involved in pathogenicity. Journal of Bacteriology 190(6): 2138-49. doi: 10.1128/JB.01595-07
Gurrero R (2016) Selección y efectividad del uso de aislamientos de Trichoderma spp. para el control del Cancro Bacteriano (Clavibacter michiganensis subsp. michiganensis) del tomate (Lycopersicum esculentum Mill.). Tesis de Maestría, UNLP. Link
Guerrero R, Mónaco CI, Stocco MC, et al. (2017) Aplicación de Trichoderma harzianum para el control del cáncer bacteriano (Clavibacter michiganensis subsp. michiganensis) del tomate (Lycopersicum esculentum mill.) en invernadero. Revista Amazónica Ciencia y Tecnología 6: 230-243. Link
Han S, Jiang N, Lv Q, Kan Y, Hao J, Li J, et al. (2018) Detection of Clavibacter michiganensis subsp. michiganensis in viable but nonculturable state from tomato seed using improved qPCR. PLoS ONE 13(5): e0196525. doi: 10.1371/journal.pone.0196525
Hiery E, Adam S, Reid S, Hofmann J, Sonnewald S, Burkovski A (2013) Genome-wide transcriptome analysis of Clavibacter michiganensis subsp. michiganensis grown in xylem mimicking médium. Journal of Biotechnology 168(4): 348-354. doi: 10.1016/j.jbiotec.2013.09.006
Hiery E, Poetsch A, Moosbauer T, Amin B, Hofmann J, Burkovski AA (2015) Proteomic study of Clavibacter michiganensis subsp. michiganensis culture supernatants. Proteomes 3: 411-423. doi: 10.3390/proteomes3040411
Hwang IS, Oh E-J, Kim D, Oh C-S (2017) Multiple plasmid-borne virulence genes of Clavibacter michiganensis ssp. capsici critical for disease development in pepper. New Phytologyst (in press). doi: 10.1111/nph.14896
Hwang IS, Oh EJ, Oh CS (2020) Transcriptional Changes of Plant Defense-Related Genes in Response to Clavibacter Infection in Pepper and Tomato. Plant Pathol J. 36(5): 450-458. doi: 10.5423/PPJ.OA.07.2020.0124
Jacques MA, Durand K, Orgeur G, Balidas S, Fricot C, Bonneau S, Quillévéré A, Audusseau C, Olivier V, Grimault V, Mathis R (2012) Phylogenetic analysis and polyphasic characterization of Clavibacter michiganensis strains isolated from tomato seeds reveal that nonpathogenic strains are distinct from C. michiganensis subsp. michiganensis. Appl Environ Microbiol. 2012 Dec;78(23):8388-402. doi: 10.1128/AEM.02158-12
Kaneshiro WS, Mizumoto CY, Alvarez AM (2006) Differentiation of Clavibacter michiganensis subsp. michiganensis from seed-borne saprophytes using ELISA, Biolog and 16S rDNA sequencing. European Journal of Plant Pathology 116: 45–56. doi: 10.1007/s10658-006-9036-1
Kawaguchi A, Tanina K (2014) Genetic groups of Clavibacter michiganensis subsp. michiganensis identified by DNA fingerprinting and the effects of inoculation methods on disease development. European Journal of Plant Pathology 140(3): 399–406. doi: 10.1007/s10658-014-0475-9
Koseoglou E, van der Wolf JM, Visser RGF, Bai Y (2021) Susceptibility reversed: modified plant susceptibility genes for resistance to bacteria. Trends in Plant Science 27: 69-79. doi: 10.1016/j.tplants.2021.07.018
Koseoglou E (2022) Identification of susceptibility determinants in the tomato-Clavibacter michiganensis pathosystem. [internal PhD, WU, Wageningen University]. Wageningen University. doi: 10.18174/574581
Ialacci GM, Bella P, Licciardello G, Strano CP, Eichenlaub R, Gartemann K-H, La Rosa R, Catara V (2016) Clonal populations of Clavibacter michiganensis subsp. michiganensis are responsible for the outbreaks of bacterial canker in greenhouse tomatoes in Italy. Plant Pathology 65: 484-495. doi: 10.1111/ppa.12424
Lamichhane JR, Balestra GM, Varvaro L (2011) Severe Outbreak of Bacterial Canker Caused by Clavibacter michiganensis subsp. michiganensis on Tomato in Central Italy. Plant Disease 95(2): 221-221. doi: 10.1094/PDIS-09-10-0635
Latin R, Tikhonova I, Rane K (1995) First report of bacterial canker of pepper in Indiana. Plant Disease 79: 860. doi: 10.1094/PD-79-0860E
Lee S, Yoon C, Lee Y, et al. (1999) Occurrence and distribution of bacterial canker of red pepper caused by Clavibacter michiganensis subsp. michignensis. Plant Dis Agri 5: 105–110. Link
Lewis Ivey ML, Miller SA (2000) First report of bacterial canker of pepper in Ohio. Plant Dis 84: 810. doi: 10.1094/PDIS.2000.84.7.810C
Li XS, Yuan XK (2017) Genome Sequences for Multiple Clavibacter Strains from Different Subspecies. Genome Announc. 5(38): e00721-17. doi: 10.1128/genomeA.00721-17
Li X, Tambong J, Yuan KX, et al. (2018) Re-classification of Clavibacter michiganensis subspecies on the basis of whole-genome and multi-locus sequence analyses. Int J Syst Evol Microbiol 68(1): 234-240. doi: 10.1099/ijsem.0.002492
Llorens E, Scalschi L, González-Hernández AI, et al. (2021) 1-Methyltryptophan Treatment Increases Defense-Related Proteins in the Apoplast of Tomato Plants. J Proteome Res. 20(1): 433-443. doi: 10.1021/acs.jproteome.0c00498
Lu Y, Hatsugai N, Katagiri F, Ishimaru CA, Glazebrook J (2015) Putative Serine Protease Effectors of Clavibacter michiganensis Induce a Hypersensitive Response in the Apoplast of Nicotiana Species. Molecular Plant-Microbe Interactions 28(11): 1216-1226. doi: 10.1094/MPMI-02-15-0036-R
Lu Y, Ishimaru CA, Glazebrook J, Samac DA (2017) Comparative Genomic Analyses of Clavibacter michiganensis subsp. insidiosus and Pathogenicity on Medicago truncatula. Phytopathology (in press). doi: PHYTO-05-17-0171-R
Maeso D, Walasek W (2015) Evaluación de desinfectantes para prevenir la trasmisión de Clavibacter michiganensis subsp. michiganensis en tomate mediante tijeras de poda. Agrociencia Uruguay 19(1): 77-83. Link
Mohd Nadzir MM, Vieira Lelis FM, Thapa B, Ali A, Visser RG, Heusden AW, Wolf JM (2018) Development of an in vitro protocol to screen Clavibacter michiganensis subsp. michiganensispathogenicity in different Solanum species. Plant Pathol. . doi:10.1111/ppa.12923
Muniroh binti Mohd Nadzir M (2018) Different approaches of combating bacterial canker in tomato: in pursuit of resistance. [internal PhD, WU, Wageningen University]. Wageningen University. doi: 10.18174/459297
Nandi M, Macdonald J, Liu P, Weselowski B, Yuan Z (2018) Clavibacter michiganensis ssp. michiganensis: bacterial canker of tomato, molecular interactions and disease management. Molecular Plant Pathology. doi: 10.1111/mpp.12678
Osdaghi E, Ansari M, Taghavi SM, et al. (2017) Pathogenicity and phylogenetic analysis of Clavibacter michiganensis strains associated with tomato plants in Iran. Plant Pathology (in press). doi: 10.1111/ppa.12801
, , , (2022) Bacterial ring rot of potato caused by Clavibacter sepedonicus: A successful example of defeating the enemy under international regulations. Molecular Plant Pathology, 00: 1– 22. doi: 10.1111/mpp.13191
Papazoglou P, Navrozidis I, Testempasis S, et al. (2025) Early detection of bacterial canker in tomato plants using spectroscopy for smart agriculture applications. Biosystems Engineering 251: 1-10. doi: 10.1016/j.biosystemseng.2025.01.009
Peritore-Galve FC, Tancos MA, Smart CD (2021) Bacterial canker of tomato: revisiting a global and economically damaging seedborne pathogen. Plant Disease. doi: 10.1094/PDIS-08-20-1732-FE
Rivero-Sosa LM, et al. (2021) Response of tomato (Solanum lycopersicum) varieties to Clavibacter michiganensis subsp. michiganensis infection. Mexican Journal of Phytopathology 40. doi: 10.18781/R.MEX.FIT.2106-8
Rolleri J (2015) Cancro Bacteriano del Tomate: Diagnóstico y Prevención de su Dispersión en el Cultivo. Tesis Magister Scientiae de la Facultad de Ciencias Agrarias y Forestales. Universidad Nacional de La Plata. Link
Romero AM, Vega D, Pizzorno R, Cordon G, Correa OS (2018) Hydraulic and leaf reflectance alterations induced by Clavibacter michiganensis subsp. michiganensis on tomato plants. European Journal of Plant Pathology 1–6. doi: 10.1007/s10658-018-1500-1
Savidor A, Teper D, Gartemann KH, Eichenlaub R, Chalupowicz L, Manulis-Sasson S, Barash I, Tews H, Mayer K, Giannone RJ, Hettich RL, Sessa G (2012) The Clavibacter michiganensis subsp. michiganensis–Tomato Interactome Reveals the Perception of Pathogen by the Host and Suggests Mechanisms of Infection. Journal of Proteome Research 11(2): 736–750. doi: 10.1021/pr200646a
Savidor A, Chalupowicz L, Teper D, Gartemann KH, Eichenlaub R, Manulis-Sasson S, Barash I, Sessa G (2014) Clavibacter michiganensis subsp. michiganensis Vatr1 and Vatr2 Transcriptional Regulators Are Required for Virulence in Tomato. Molecular Plant-Microbe Interactions 27(10): 1035-1047. doi: 10.1094/MPMI-02-14-0061-R
Sen Y, Feng Z, Vandenbroucke H, et al. (2013) Screening for new sources of resistance to Clavibacter michiganensis subsp. michiganensis (Cmm) in tomato. Euphytica 190: 309–317. doi: 10.1007/s10681-012-0802-1
Sen Y, van der Wolf J, Visser RGF, van Heusden S (2015) Bacterial Canker of Tomato: Current Knowledge of Detection, Management, Resistance, and Interactions. Plant Disease 99: 4-13. doi: 10.1094/PDIS-05-14-0499-FE
Sen Y, Aysan Y, Mirik M, Ozdemir D, Meijer-Dekens F, van der Wolf JM, Visser RGF, van Heusden S (2017) Genetic Characterization of Clavibacter michiganensis subsp. michiganensis Population in Turkey. Plant Disease (in press). doi: PDIS-02-17-0276-RE
Sharabani, G., Shtienberg, D., Borenstein, M., Shulhani, R., Lofthouse, M., Sofer, M., Chalupowicz, L., Barel, V. and Manulis-Sasson, S. (2013), Effects of plant age on disease development and virulence of Clavibacter michiganensis subsp. michiganensis on tomato. Plant Pathology 62: 1114–1122. doi: 10.1111/ppa.12013
Sharabani G, Manulis-Sasson S, Chalupowicz L, Borenstein M, Shulhani R, Lofthouse M, Sofer M, Frenkel O, Dror O, Shtienberg D (2014) Temperature at the early stages of Clavibacter michiganensis subsp. michiganensis infection affects bacterial canker development and virulence gene expression. Plant Pathology 63: 1119–1129. doi: 10.1111/ppa.12199
Stocco M, Rolleri J, Moya P, et al. (2024) Preliminary findings on biocontrol of bacterial wilt and canker of tomato (Clavibacter michiganensis subsp. michiganensis) using Trichoderma harzianum after biofumigation. Agron. Colomb. 42(2): e114659. Link
Tambong JT (2017) Comparative genomics of Clavibacter michiganensis subspecies, pathogens of important agricultural crops. PLoS ONE 12(3): e0172295. doi: 10.1371/journal.pone.0172295
Tancos MA, Chalupowicz L, Barash I, Manulis-Sasson S, Smart CD (2013) Tomato Fruit and Seed Colonization by Clavibacter michiganensis subsp. michiganensis through External and Internal Routes. Applied and Environmental Microbiology 79(22): 6948-6957. doi: 10.1128/AEM.02495-13
Tancos MA, Lange HW, Smart CD (2015) Characterizing the Genetic Diversity of the Clavibacter michiganensis subsp. michiganensis Population in New York. Phytopathology 105(2): 169-179. doi: 10.1094/PHYTO-06-14-0178-R
Tancos MA, Lowe-Power TM, Peritore-Galve FC, Tran TM, Allen C, Smart CD (2017) Plant-like bacterial expansins play contrasting roles in two tomato vascular pathogens. Molecular Plant Pathology (in press). doi: 10.1111/mpp.12611
Thapa SP, Pattathil S, Hahn MG, Jacques MA, Gilbertson RL, Coaker G (2017) Genomic Analysis of Clavibacter michiganensis Reveals Insight Into Virulence Strategies and Genetic Diversity of a Gram-Positive Bacterial Pathogen Molecular Plant-Microbe Interactions 30(10): 786-802. doi: 10.1094/MPMI-06-17-0146-R
Tripathi R, Tiwari R, Vishunavat K (2018) Evaluation of Different Growth Media for Clavibacter michiganensis subsp michiganensis and Formation of Biofilm like Structures. Int. J. Curr. Microbiol. App. Sci. 7(5): 207-216. doi: 10.20546/ijcmas.2018.705.027
Valenzuela M, Besoain X, Durand K, Cesbron S, Fuentes S, Claverías F, Jacques MA, Seeger M (2018) Clavibacter michiganensis subsp. michiganensis strains from central Chile exhibit low genetic diversity and sequence types match strains in other parts of the world. Plant Patholology. doi: 10.1111/ppa.12911
Vega D (2015) Rol epidemiológico de restos culturales y semillas en el desarrollo del cancro bacteriano del tomate en invernaderos del cinturón verde Buenos Aires – La Plata. Tesis de Maestría, EPG-FAUBA. Link
Vega D, Romero AM (2016) Survival of Clavibacter michiganensis subsp. michiganensis in tomato debris under greenhouse conditions. Plant Pathology 65: 545-550. doi: 10.1111/ppa.12444
Wang Y, Deng S, Li Z, Yang W (2022) Advances in the Characterization of the Mechanism Underlying Bacterial Canker Development and Tomato Plant Resistance. Horticulturae 8(3): 209. doi: 10.3390/horticulturae8030209
Wassermann E (2017) Estructura poblacional y caracterización genética de los factores de patogenicidad de cepas de Clavibacter michiganensis subsp. michiganensis, presentes en el cinturón verde de Buenos Aires-La Plata. Tesis doctoral, EPG FAUBA. Link
Wassermann E, Montecchia MS, Correa OS, Vega D, Romero A (2017) Clavibacter michiganensis subsp. michiganensis strains virulence and genetic diversity. a first study in Argentina. European Journal of Plant Pathology 149(1): 35–42. doi: 10.1007/s10658-017-1159-z
Xu X, Kumar A, Deblais L, Pina-Mimbela R, Nislow C, Fuchs JR, Miller SA and Rajashekara G (2015) Discovery of novel small molecule modulators of Clavibacter michiganensis subsp. michiganensis. Frontiers in Microbiology 6: 1127. doi: 10.3389/fmicb.2015.01127
Yim KO, Lee HI, Kim JH, et al. (2012) Characterization of phenotypic variants of Clavibacter michiganensis subsp. michiganensis isolated from Capsicum annuum . Eur J Plant Pathol 133: 559–575. doi: 10.1007/s10658-011-9927-7
Załuga J, Stragier P, Baeyen S, Haegeman A, Van Vaerenbergh J, Maes M, De Vos P (2014) Comparative genome analysis of pathogenic and non-pathogenic Clavibacter strains reveals adaptations to their lifestyle. BMC Genomics 15: 392. doi: 10.1186/1471-2164-15-392
Zárate-Martínez W, González-Morales S, Ramírez-Godina F, Robledo-Olivo A, Juárez-Maldonado A (2018) Efecto de los ácidos fenólicos en plantas de tomate (Lycopersicon esculentum Mill.) inoculadas con Clavibacter michiganensis. Revista Mexicana de Ciencias Agrícolas volumen especial número 20: 4367-4379. Link
Zhou Y, Zhang Z, Bao Z, et al. (2022) Graph pangenome captures missing heritability and empowers tomato breeding. Nature. doi: 10.1038/s41586-022-04808-9