Hongos toxigénicos
Basándose en su origen, los hongos toxigénicos se clasifican comúnmente en dos categorías: ‘hongos de campo’ y ‘hongos de almacenamiento’ (Mohapatra et al., 2017). Los ‘hongos de campo’ infectan los granos en condiciones de cultivo y, generalmente, no resisten un almacenamiento prolongado, ya que requieren un alto contenido de agua (aw > 0.9) para sobrevivir. Ejemplos de estos hongos incluyen especies de los géneros Alternaria y Fusarium. Por el contrario, los géneros Penicillium y Aspergillus incluyen especies que suelen invadir los granos durante el almacenamiento, por lo que se conocen como ‘hongos de almacenamiento’. Estos no están predominantemente presentes antes de la cosecha, sin embargo, luego de unas pocas semanas de almacenamiento, crecen a un ritmo muy alto cuando prevalecen condiciones adecuadas para ello. Los hongos de almacenamiento pueden crecer a una actividad de agua más baja que los hongos de campo (aw = 0.70–0.75).
.
Tabla 1. Hongos que generan micotoxinas en granos almacenados y las toxinas que producen. Extraído y traducido de Mohapatra et al. (2017).
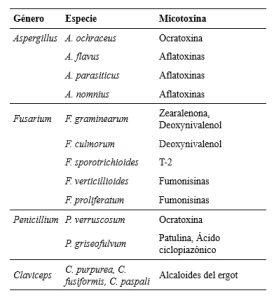
.
Aspergillus y Fusarium son los géneros que reúnen las especies de hongos productores de micotoxinas más importantes asociados con alimentos y piensos (Mohapatra et al. 2017). Cada especie toxigénica puede, potencialmente, producir una o varias micotoxinas (Fig. 1).
.
Fig. 1. Especies de hongos toxigénicos clasificadas según el grupo de micotoxinas que producen (extraído de Kępińska-Pacelik & Biel, 2021).

.
Condiciones predisponentes para la contaminación con micotoxinas
La presencia de un hongo toxigénico no implica necesariamente la producción de la micotoxina ya que, más allá de su capacidad genética, es necesario que ocurran ciertos factores condicionantes para que crezca, colonice la matriz y sintetice una micotoxina determinada. Entre los factores que condicionan el desarrollo de hongos y la producción de micotoxinas mientras el cultivo está en el campo, Gimeno & Martins (2011) citan: i) factores físicos (humedad o agua libre y actividad de agua -aw-, temperatura, zonas de microflora e integridad física de los granos), ii) factores químicos (pH, composición del sustrato, nutrientes minerales, potencial de oxido-reducción, relación O2/CO2), y iii) factores biológicos (cepa específica del hongo, capacidad toxigénica, fuente y tamaño de inóculo, interacciones microbianas, presencia de insectos). A estos factores, Ramos et al. (2015) agregan una cuarta categoría correspondiente al factor prácticas agrícolas, es decir, aquellos aspectos que afectan al cultivo desde la siembra hasta la cosecha (fechas de siembra y cosecha, resistencia varietal, manejo de plagas, entre otros). A modo de ejemplo, Bocianowski et al. (2020) describen diversos factores que pueden propiciar la aparición del complejo de hongos causantes de la Podredumbre del grano y de la espiga de maíz en el campo, dentro del cual se incluyen especies toxigénicas de los géneros Fusarium y Stenocarpella. Los factores mencionados son: i) estrés térmico o hídrico, ii) daños físicos provocados por granizos, insectos u otros factores bióticos, iii) prácticas de manejo inadecuadas, como fechas de siembra y cosecha no óptimas, iv) altas densidades de siembra, v) control ineficaz de malezas e insectos, y vi) características genéticas y morfológicas de las plantas, como la susceptibilidad o resistencia y atributos como la longitud de las chalas o la compacidad de los granos, que influyen en su mayor o menor capacidad de protección contra la invasión fúngica, entre otros factores. La Fusariosis de la espiga del trigo, provocada por especies del complejo Fusarium graminearum (FGSC), se intensifica cuando las fases de espigazón, floración y comienzo del llenado del grano coinciden con periodos de alta humedad y temperaturas moderadas a cálidas. Aunque esta enfermedad no se presenta con alta frecuencia anualmente en los campos, puede extenderse ampliamente cuando la humedad relativa ambiental supera el 80% y las temperaturas son cercanas a los 20°C durante la floración y formación del grano (Bartosik et al., 2012). Debido a esto, el manejo efectivo de la enfermedad depende en gran medida de la capacidad para predecir su aparición basándose en las condiciones climáticas (Moschini et al., 2016), asi como en la diversificación de las fechas de siembra y el uso de materiales resistentes (Yerkovich, 2019).
Matrices alimentarias propensas a la contaminación por micotoxinas
En la investigación alimentaria, se utiliza el concepto de ‘matriz alimentaria’ para describir la composición compleja de los alimentos. Este término alude a la totalidad de la estructura físico-química del alimento, incluyendo nutrientes, agua, fibra, aditivos y contaminantes. Entender un alimento como una matriz compleja es crucial para analizar su vulnerabilidad a la contaminación por micotoxinas.
Las micotoxinas pueden estar presentes en todas las etapas de la cadena alimentaria, desde los cultivos en el campo hasta los alimentos procesados, incluyendo los piensos y los alimentos crudos o sin procesar (Ramos-Girona et al. 2020). Los cereales, frutos secos, semillas oleaginosas, frutas deshidratadas, café, cacao, especias, y sus respectivos derivados, son las matrices alimentarias que con mayor frecuencia se contaminan con micotoxinas (OMS, 2023). La contaminación de los alimentos procesados como pan, pastas, bebidas como café, vino, cerveza, zumos de manzana, cereales de desayuno y compotas suele proceder de la contaminación natural de sus materias primas. Generalmente, estas micotoxinas no se destruyen durante las distintas etapas de procesamiento del alimento como cocción, fritura, horneado, destilación y fermentación (Kępińska-Pacelik & Biel, 2021). En el caso de la contaminación de alimentos de origen animal como leche, carne o huevos, ésta procede del consumo de alimentos contaminados por parte de los animales de granja (Ramos-Girona et al. 2020).
Contaminación de cereales y oleaginosas
Entre los hongos toxigénicos que afectan a los cultivos, Miller (1995) define cuatro grupos basándose en las interacciones hongo-planta en diferentes etapas de producción: i) fitopatógenos agresivos (como Fusarium graminearum), ii) fitopatógenos oportunistas que crecen y producen micotoxinas en plantas senescentes o estresadas (como Fusarium verticillioides y Aspergillus flavus), iii) hongos que inicialmente colonizan la planta y predisponen el producto a la contaminación por micotoxinas después de la cosecha (como Aspergillus flavus) y iv) hongos que se encuentran en el suelo o material vegetal en descomposición y luego proliferan en el almacenamiento si las condiciones lo permiten (como Penicillium verrucosum y Aspergillus ochraceus). La presencia de micotoxinas es frecuente en los cereales y oleaginosas (Chiotta et al., 2020; Kępińska-Pacelik & Biel 2021). La contaminación de las materias primas con micotoxinas se produce como resultado de la infección o infestación de las plantas por hongos durante el ciclo del cultivo, la cosecha o la postcosecha. En Argentina, es común la presencia de toxinas en granos como el maíz, trigo y cebada (Munkvold et al. 2019; Castañares et al. 2014, 2019). Además, entre las oleaginosas, la soja y el maní a menudo presentan contaminación por micotoxinas (Chiotta et al. 2020).
.
Fig. 2. Espiga de maíz con granos deteriorados debido a la colonización de hongos como Fusarium verticillioides y Stenocarpella sp. (Autor: María Cecilia Pérez Pizá).

.
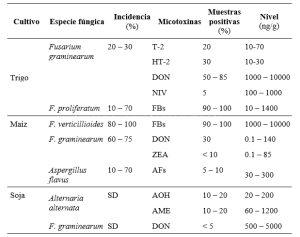
.
Regulaciones
La forma más adecuada de evitar las intoxicaciones por micotoxinas es impedir la ingesta de alimentos contaminados. En este sentido, para proteger la salud de las personas y de los animales, resulta necesario limitar su exposición a las micotoxinas a través de la regulación de límites máximos admisibles de toxinas en los alimentos, de manera que, si la materia prima supera los límites establecidos, sea derivada a otros destinos, pero no ingerida. Hasta la fecha, las principales micotoxinas sujetas a regulación en alimentos destinados al consumo humano son: AF (B1, B2, G1, G2 y M1), OTA, patulina, ZEA, FB (B1 y B2), DON, T-2, HT-2 y citrinina.
Las regulaciones sobre la presencia de micotoxinas en los alimentos son sugeridas por el Joint Expert Committee in Food Additives (Comité Mixto FAO-OMS de Expertos sobre Aditivos Alimentarios, JECFA), un comité internacional de expertos científicos administrado conjuntamente por la Food and Agriculture Organization of the United Nations (Organización de las Naciones Unidas para la Alimentación y la Agricultura, FAO) y la World Health Organization (Organización Mundial de la Salud, OMS). La Unión Europea, por su parte, posee un marco legislativo creado por la European Commission (Comisión Europea, EC), en cuyas reglamentaciones se limita la presencia de AF, FB, DON, OTA y ZEA en los productos de las cadenas de suministro de alimentación humana y animal (Reglamento (UE) 2023/915 de la Comisión). Además, existe un conjunto de normas para alimentos y piensos aprobadas por la Codex Alimentarius Comission (Comisión del Codex Alimentarius, CAC), establecida como parte de un programa conjunto entre la FAO y la OMS, las que se encuentran plasmadas en el Codex Alimentarius. Estas normas establecen los niveles permitidos de AF (M1 y totales), DON, FB, OTA y patulina en materias primas, alimentos para humanos y piensos. En Argentina, la Comisión Nacional de Alimentos (CONAL) establece en el Código Alimentario Argentino (CAA, Res. 22/2019) los niveles máximos permitidos de AF (B1+B2+G1+G2) en maíz, maní y sus drivados. Para otras micotoxinas, como DON, FB (B1 y B2) y OTA, que podrían estar presentes en café, pasas de uva y productos derivados de cereales (maíz y trigo), se adoptan los límites regulados por las legislaciones internacionales (Reglamento (UE) 2023/915 de la Comisión y el Codex Alimentarius).
Potencial carcinogénico de las micotoxinas en humanos
La International Agency for Research on Cancer (IARC), o Agencia Internacional de Investigaciones sobre el Cáncer, realiza una constante evaluación de estudios sobre micotoxinas para establecer su potencial carcinogénico en seres humanos. De este modo, la IARC ofrece una categorización de las micotoxinas en grupos, basándose en su relación con la inducción de cáncer (Claeys et al. 2020). Las cuatro aflatoxinas principales (AFB1, AFB2, AFG1 y AFG2) están clasificadas en el Grupo 1, identificadas como carcinógenos confirmados en humanos. La aflatoxina M1 (AFM1), las fumonisinas y la ocratroxina A están en el Grupo 2B, lo que indica evidencia limitada de su asociación con el cáncer en humanos, por lo que se consideran posiblemente carcinogénicas para humanos. Por otro lado, la zearalenona (ZEN), el deoxinivalenol (DON), las toxinas T-2 y HT-2, la patulina (PAT) y la citrinina (CIT) se clasifican en el Grupo 3, con evidencia limitada o insuficiente en animales y, por tanto, no se pueden clasificar como carcinogénicas para humanos (Claeys et al. 2020; Ramos-Girona et al. 2020).
Manejo de la contaminación de alimentos con micotoxinas
El control efectivo de la contaminación de alimentos por micotoxinas comienza con la prevención de su acumulación en el campo. Por ello, resulta crucial prevenir situaciones que propicien la aparición y multiplicación de los hongos productores de estas toxinas. Las condiciones a prevenir incluyen: i) estrés térmico o hídrico, ii) daños físicos (por granizos, insectos u otros factores bióticos), iii) prácticas de manejo inapropiadas (fechas de siembra y de cosecha inadecuadas), iv) altas densidades de siembra, v) control deficiente de malezas e insectos, y vi) siembra de materiales susceptibles (Romagnoli & Silva, 2009; Bocianowski et al., 2020).
Las condiciones durante la cosecha, poscosecha, transporte y almacenamiento son cruciales para prevenir el desarrollo de hongos toxigénicos y la síntesis de micotoxinas en las materias primas. Por lo tanto, si bien la fuente de inóculo de estos hongos es normalmente el cultivo en el campo (cuando existen condiciones ambientales para su colonización), durante la cosecha se pueden realizar prácticas que permitan disminuir la presencia de los hongos en la poscosecha. Entre las prácticas que pueden realizarse durante la cosecha para minimizar la contaminación de granos se incluyen: i) regulación del cabezal, ii) regulación del sistema de trilla, y iii) regulación del sistema de limpieza (Bartosik et al., 2012).
Durante la postcosecha, es importante evitar reproducir las condiciones favorables para el crecimiento y la diseminación de los hongos y para la síntesis de micotoxinas. Entre las estrategias más efectivas para este fin, se citan la evaluación en la recepción de las materias primas en las plantas de acopio y la eliminación física de los granos afectados mediante clasificación o limpieza (Bullerman & Bianchini, 2007). Además, es crucial tener en cuenta la humedad del grano que se almacena. A modo de ejemplo, cuando los granos de cereales se almacenan a menos de 14% de humedad se disminuye significativamente el riesgo de generación de micotoxinas durante el almacenamiento (Bartosik et al., 2012).
Durante el procesamiento de materias primas para la elaboración de alimentos, diversos procesos pueden tener lugar, con efectos variados sobre el contenido de micotoxinas en los alimentos finales (Ramos-Girona et al. 2020). La molienda, por ejemplo, puede distribuir las micotoxinas desigualmente en las fracciones resultantes, acumulándolas en algunas de ellas (Bartosik et al., 2012). En la molienda húmeda, las micotoxinas pueden disolverse en agua y acumularse en el germen y la fibra de gluten, dejando el almidón con menos contaminación (Ramos-Girona et al. 2020; Bullerman & Bianchini, 2007). La fermentación puede aumentar o disminuir la concentración de micotoxinas en la harina y la masa, dependiendo de las condiciones de fermentación y de los microorganismos involucrados (Bergamini et al., 2010; Vidal et al., 2016). El tratamiento térmico (pasteurización, tostado, horneado) comúnmente reduce la contaminación microbiológica, pero tiene resultados variables en la reducción de micotoxinas debido a su estabilidad térmica y química. Por ejemplo, las aflatoxinas resisten temperaturas superiores a 100° C, pero puede reducirse su contaminación empleando tratamientos térmicos a presión (Milani & Maleki, 2014). Es importante destacar que, como resultado del procesamiento de alimentos, las micotoxinas pueden reaccionar con ingredientes incorporados o unirse a componentes de la matriz alimentaria, transformándose en formas modificadas cuyos efectos toxicológicos no son del todo conocidos. Por lo tanto, la desaparición de micotoxinas en los análisis no implica necesariamente su ausencia real o una disminución de toxicidad, ya que los productos de descomposición pueden ser tan peligrosos como las micotoxinas originales (Ramos-Girona et al. 2020).
Asegurar la ausencia de micotoxinas en la ración de los animales de granja es una tarea difícil (Wielogórska et al., 2016). Además de las buenas prácticas agrícolas para prevenir la contaminación de los piensos, se han desarrollado estrategias para reducir la absorción de micotoxinas en el tracto digestivo de los animales mediante aditivos que pueden funcionar como agentes secuestrantes o detoxificantes. Este gran grupo de aditivos, conocidos como adsorbentes o biotransformadores, incluyen sustancias que pueden suprimir o reducir la absorción, promover la excreción de micotoxinas o modificar su modo de acción (Commission Regulation (EC) No. 386/2009). Los adsorbentes se añaden a la dieta animal para limitar la biodisponibilidad de micotoxinas, reduciendo así su exposición. Estos compuestos se unen a las micotoxinas en los piensos y pasan a través del sistema digestivo del animal, siendo eliminados en las heces. Los adsorbentes inorgánicos, como ciertos tipos de arcillas y silicatos, han mostrado eficacia en la adsorción de aflatoxinas (Kong et al., 2014), pero son menos efectivos contra micotoxinas producidas por Fusarium (Harper et al., 2010). Por otro lado, los adsorbentes orgánicos (paredes celulares de levaduras, fibras micronizadas o bio-sorbentes como el orujo de uva) parecen tener mayor efectividad contra un amplio espectro de micotoxinas (Avantaggiato et al., 2014). La combinación de diferentes tipos de adsorbentes podría ser más adecuada para piensos contaminados con múltiples micotoxinas, representando un desafío actual en este campo (Vila-Donat et al., 2018). Los agentes biotranformadores, por otra parte, pueden ser enzimas o microorganismos (bacterias, levaduras y mohos) que degraden las micotoxinas a metabolitos menos tóxicos. La falta de conocimiento sobre los mecanismos de transformación y la seguridad de los productos resultantes limita su uso generalizado (Wielogórska et al., 2016).
.
Bibliografía
Avantaggiato G, Greco D, Damascelli A, et al. (2014) Assessment of multi-mycotoxin adsorption efficacy of grape pomace. Journal of Agricultural and Food Chemistry 62 (2): 497-507. doi: 10.1021/jf404179h
Awuchi CG, Nyakundi Ondari E, Nwozo S, et al. (2022) ‘Mycotoxins’. Toxicological mechanisms involving humans, livestock and their associated health concerns: a review. Toxins 14: 167. doi: 10.3390/toxins14030167
Bakker MG, Brown DW, Kelly AC, et al. (2018) Fusarium mycotoxins: a trans-disciplinary overview. Canadian Journal of Plant Pathology 40(2): 161-171. doi: 10.1080/07060661.2018.1433720
Bartosik R, Castellari C, Cardoso L, et al. (2012) Manejo de Trigo con Fusariosis en la Poscosecha. Link
Bennett JW, Klich M (2003) Mycotoxins. Clin Microbiol Rev. 16(3): 497-516. doi: 10.1128/cmr.16.3.497-516.2003
Bergamini E, Catellani D, Dall’Asta C, et al. (2010) Fate of Fusarium mycotoxins in the cereal product supply chain: The deoxynivalenol (DON) case within industrial baking process in the bread-making technology. Food Additives and Contaminants 27 (5): 677-687. doi: 10.1080/19440041003660117
Bertero A, Moretti A, Spicer LJ, Caloni F (2018 ) Fusarium Molds and Mycotoxins: Potential Species-Specific Effects. Toxins (Basel) 10(6): 244. doi: 10.3390/toxins10060244
Bocianowski J, Szulc P, Waśkiewicz A, Cyplik A (2020) The effect of agrotechnical factors on Fusarium mycotoxins level in maize. Agriculture 10(11): 528. doi: 10.3390/agriculture10110528
Bullerman LB, Bianchini A (2007) Stability of mycotoxins during food processing. International Journal of Food Microbiology 119 (1-2): 140-146. doi: 10.1016/j.ijfoodmicro.2007.07.035
Castañares E, Albuquerque DR, Dinolfo MI, et al. (2014) Trichothecene genotypes and production profiles of Fusarium graminearum isolates obtained from barley cultivated in Argentina. International journal of food microbiology 179: 57-63. doi: 10.1016/j.ijfoodmicro.2014.03.024
Castañares E, Martínez M, Cristos D, et al. (2019) Fusarium species and mycotoxin contamination in maize in Buenos Aires province, Argentina. European Journal of Plant Pathology 155 (4): 1265-1275. doi: 10.1007/s10658-019-01853-5
Claeys L, Romano C, De Ruyck K, et al. (2020) Mycotoxin exposure and human cancer risk: A systematic review of epidemiological studies. Comprehensive Reviews in Food Science and Food Safety, 19(4), 1449-1464. doi: 10.1111/1541-4337.12567
Comisión Nacional de Alimentos (CONAL) (2019) Código Alimentario Argentino, Resolución Conjunta 22/2019. Secretaria de Alimentos, Bieoconomía y Desarrollo Regional . Link
Ferrigo D, Raiola A, Causin R (2016) Fusarium Toxins in Cereals: Occurrence, Legislation, Factors Promoting the Appearance and Their Management. Molecules 21(5): 627. doi: 10.3390/molecules21050627
Gimeno A y Martins ML. 2011. Micotoxinas y micotoxicosis en animales y humanos. Special Nutrients, Florida. pp. 50-53. Link
Harper AF, Estienne MJ, Meldrum JB, et al. (2010) Assessment of a hydrated sodium calcium aluminosilicate agent and antioxidant blend for mitigation of aflatoxin-induced physiological alterations in pigs. Journal of Swine Health Production 18 (6): 282-289. Link
Kępińska-Pacelik J, Biel W (2021) Alimentary Risk of Mycotoxins for Humans and Animals. Toxins 13(11), 822. doi: 10.3390/toxins13110822
Kong C, Shin SY, Kim BG (2014) Evaluation of mycotoxin sequestering agents for aflatoxin and deoxynivalenol: an in vitro approach. SpringerPlus 3: 346. doi: 10.1186/21931801-3-346
Kuiper-Goodman T (1995) Mycotoxins: risk assessment and legislation. Toxicology Letters, 82: 853-859. doi: 10.1016/0378-4274(95)03599-0
Kumar P, Mahato DK, Kamle M, et al. (2017) Aflatoxins: A Global Concern for Food Safety, Human Health and Their Management. Front. Microbiol. 7: 2170. doi: 10.3389/fmicb.2016.02170
Mielniczuk E, Skwaryło-Bednarz B (2020) Fusarium Head Blight, Mycotoxins and Strategies for Their Reduction. Agronomy 10(4): 509. doi: 10.3390/agronomy10040509
Milani J, Maleki G (2014) Effects of processing on mycotoxin stability in cereals. Journal of the Science of Food and Agriculture 94 (12): 2372-2375. doi: 10.1002/jsfa.6600
Miller JD (1995) Fungi and mycotoxins in grain: implications for stored product research. Journal of Stored Products Research 31(1): 1–16. doi: 10.1016/0022-474X(94)00039-V
Mohapatra D, Kumar S, Kotwaliwale N, Singh KK (2017) Critical factors responsible for fungi growth in stored food grains and non-Chemical approaches for their control. Industrial Crops and Products 108: 162-182. doi: 10.1016/j.indcrop.2017.06.039
Moschini RC, Acuña M, Alberione E, et al. (2016) Validación de sistemas de pronóstico del impacto de la fusariosis de la espiga en cultivares de trigo. Meteorologica 41(1): 37-46. Link
Munkvold GP, Arias S, Taschl I, Gruber-Dorninger C (2019) Mycotoxins in corn: Occurrence, impacts, and management. En: Corn (235-287 pp.). AACC International Press. doi: 10.1016/B978-0-12-811971-6.00009-7
OMS – Organización Mundial de la Salud (2023) Micotoxinas. Link
Payne GA, Brown MP (1998) Genetics and physiology of aflatoxin biosynthesis. Annu. Rev. Phytopathol. 36: 329–362. doi: 10.1146/annurev.phyto.36.1.329
Perincherry L, Lalak-Kańczugowska J, Stępień Ł (2019) Fusarium-Produced Mycotoxins in Plant-Pathogen Interactions. Toxins (Basel): 11(11): 664. doi: 10.3390/toxins11110664
Pitt JI (2000) Toxigenic fungi and mycotoxins. British Medical Bulletin 56(1): 184-192. doi: 10.1258/0007142001902888
Presello DA, Pereyra AO, Iglesias J, et al. (2011) Responses to selection of S5 inbreds for broad-based resistance to ear rots and grain mycotoxin contamination caused by Fusarium spp. in maize. Euphytica 178: 23-29. doi: 10.1007/s10681-010-0255-3
Ramos AJ, Sanchis V, y Marin S. (2015). Las micotoxinas: un problema que resurge con fuerza. Grandes Cultivos. pp. 4-8. Link
Ramos-Girona AJ, Marín Sillué S, Molino Gahete F, et al. (2020). Las micotoxinas: el enemigo silencioso. Arbor (Consejo Superior de Investigaciones Científicas) 196 (795): 540. doi: 10.3989/arbor.2020.795n1004
Ribes FM, Espejo J (2020) Requisitos para importación en Europa: Caso de maíz Flint. En: Maíz Flint: Producción sustentable y calidad de grano. Borrás L (ed). Dacsa Group. Link
Romagnoli MS y Silva PS. 2009. Las Micotoxinas. ¿Qué sabemos sobre esta problemática?. Revista Agro Mensaje de la Facultad. Instituto De Genética Experimental, Facultad De Ciencias Médicas. Universidad Nacional Del Rosario. Argentina. Link
Vidal A, Ambrosio A, Sanchis V, et al. (2016) Enzyme bread improvers affect the stability of deoxynivalenol and deoxynivalenol-3-glucoside during breadmaking. Food Chemistry 208: 288-296. doi: 10.1016/j.foodchem.2016.04.003
Vila-Donat P, Marín S, Sanchis V, Ramos AJ (2018) A review of the mycotoxin adsorbing agents, with an emphasis on their multi-binding capacity, for animal feed decontamination. Food and Chemical Toxicology 114: 246-259. doi: 10.1016/j.fct.2018.02.044
Wielogórska E, MacDonald S, Elliot CT (2016) A review of the efficacy of mycotoxin detoxifying agents used in feed in light of changing global environment and legislation. World Mycotoxin Journal 9 (3): 419-433. doi: 10.3920/WMJ2015.1919
Xu D, Xue M, Shen Z, et al. (2021) Phytotoxic Secondary Metabolites from Fungi. Toxins. 13(4): 261. doi: 10.3390/toxins13040261
Yerkovich, N. (2019). Poblaciones del complejo Fusarium graminearum aisladas de trigo en Argentina: resistencia de nuevos germoplasmas de Triticum aestivum L. a la fusariosis de la espiga. Link
Zinedine A, El-Akhdari S (2021) Food safety and climate change: case of mycotoxins. In Research anthology on food waste reduction and alternative diets for food and nutrition security. IGI Global. pp 39-62. doi: 10.4018/978-1-7998-5354-1.ch003
.